Chemistry
Chapter 5
Surface Chemistry (पृष्ठ रसायन)
Hindi Medium
Extra Questions Ncert - 2019
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
अधिशोषण, अधिशोष्य तथा अधिशोषक से आप क्या समझते हैं? (2016)
उत्तर
अधिशोषण– किसी ठोस अथवा द्रव के पृष्ठ द्वारा किसी पदार्थ के अणुओं को आकर्षित और धारित करने की परिघटना जिसके कारण अणुओं की पृष्ठ पर सान्द्रता में वृद्धि हो जाती है, अधिशोषण कहलाती है।
अधिशोष्य– अणुक स्पीशीज या पदार्थ जो कि पृष्ठ पर सान्द्रित या संचित होता है, अधिशोष्य कहलाता है। अधिशोषक-अणुक स्पीशीज या पदार्थ जिसके पृष्ठ पर अधिशोषण होता है, अधिशोषक कहलाता है।
अधिशोषण, अधिशोष्य तथा अधिशोषक से आप क्या समझते हैं? (2016)
उत्तर
अधिशोषण– किसी ठोस अथवा द्रव के पृष्ठ द्वारा किसी पदार्थ के अणुओं को आकर्षित और धारित करने की परिघटना जिसके कारण अणुओं की पृष्ठ पर सान्द्रता में वृद्धि हो जाती है, अधिशोषण कहलाती है।
अधिशोष्य– अणुक स्पीशीज या पदार्थ जो कि पृष्ठ पर सान्द्रित या संचित होता है, अधिशोष्य कहलाता है। अधिशोषक-अणुक स्पीशीज या पदार्थ जिसके पृष्ठ पर अधिशोषण होता है, अधिशोषक कहलाता है।
प्रश्न 2.
धनात्मक तथा ऋणात्मक अधिशोषण को स्पष्ट कीजिए।
उत्तर
जब अधिशोषित (अधिशोष्य) की सान्द्रता अधिशोषक के अभ्यन्तर की अपेक्षा उसकी सतह पर अधिक होती है, तोघटना को धनात्मक अधिशोषण (positive adsorption) कहा जाता है। इसके विपरीत, यदि अधिशोषित की सान्द्रता अधिशोषक के अभ्यन्तर की तुलना में इसकी सतह पर कम है तो घटना को ऋणात्मक अधिशोषण (negative adsorption) कहा जाता है।
धनात्मक तथा ऋणात्मक अधिशोषण को स्पष्ट कीजिए।
उत्तर
जब अधिशोषित (अधिशोष्य) की सान्द्रता अधिशोषक के अभ्यन्तर की अपेक्षा उसकी सतह पर अधिक होती है, तोघटना को धनात्मक अधिशोषण (positive adsorption) कहा जाता है। इसके विपरीत, यदि अधिशोषित की सान्द्रता अधिशोषक के अभ्यन्तर की तुलना में इसकी सतह पर कम है तो घटना को ऋणात्मक अधिशोषण (negative adsorption) कहा जाता है।
प्रश्न 3.
अधिशोषण की ऊष्मा अथवा अधिशोषण की एन्थैल्पी को परिभाषित कीजिए।
उत्तर
अधिशोषण एक ऊष्माक्षेपी प्रक्रम है और इसमें ऊर्जा का उत्सर्जन होता है। किसी अधिशोषक की सतह पर अधिशोषित के एक मोल की अधिशोषण प्रक्रिया में निहित एन्थैल्पी परिवर्तन (उत्सर्जित ऊष्मा) को अधिशोषण की एन्थैल्पी (enthalpy of adsorption) या अधिशोषण की ऊष्मा (heat of adsorption) कहा जाता है।
अधिशोषण की ऊष्मा अथवा अधिशोषण की एन्थैल्पी को परिभाषित कीजिए।
उत्तर
अधिशोषण एक ऊष्माक्षेपी प्रक्रम है और इसमें ऊर्जा का उत्सर्जन होता है। किसी अधिशोषक की सतह पर अधिशोषित के एक मोल की अधिशोषण प्रक्रिया में निहित एन्थैल्पी परिवर्तन (उत्सर्जित ऊष्मा) को अधिशोषण की एन्थैल्पी (enthalpy of adsorption) या अधिशोषण की ऊष्मा (heat of adsorption) कहा जाता है।
प्रश्न 4.
उत्प्रेरक क्या है? इसके प्रमुख लक्षण लिखिए। (2009, 11)
उत्तर
उत्प्रेरक– वह पदार्थ जो किसी रासायनिक अभिक्रिया के वेग को परिवर्तित कर देता है, परन्तु स्वयं अभिक्रिया के अन्त में मात्रा तथा संघटन की दृष्टि से अपरिवर्तित रहता है, उत्प्रेरक कहलाता है।
लक्षण
उत्प्रेरक क्या है? इसके प्रमुख लक्षण लिखिए। (2009, 11)
उत्तर
उत्प्रेरक– वह पदार्थ जो किसी रासायनिक अभिक्रिया के वेग को परिवर्तित कर देता है, परन्तु स्वयं अभिक्रिया के अन्त में मात्रा तथा संघटन की दृष्टि से अपरिवर्तित रहता है, उत्प्रेरक कहलाता है।
लक्षण
- उत्प्रेरक अभिक्रिया के दौरान अपरिवर्तित रहता है।
- उत्प्रेरक की सूक्ष्म मात्रा ही अभिक्रिया की गति को परिवर्तित करने के लिए पर्याप्त होती है।
- उत्प्रेरक क्रिया प्रारम्भ नहीं कर सकता है।
- उत्प्रेरक साम्यावस्था को प्रभावित नहीं करता है।
प्रश्न 5.
धनात्मक उत्प्रेरक पर टिप्पणी लिखिए। या धनात्मक उत्प्रेरण क्या है?
उत्तर
वे उत्प्रेरक जो अभिक्रिया के वेग को बढ़ा देते हैं, उन्हें धनात्मक उत्प्रेरक कहते हैं तथा इस घटना को धनात्मक उत्प्रेरण कहते हैं।
उदाहरणार्थ– वनस्पति तेल का वनस्पति घी में हाइड्रोजनीकरण निकिल की उपस्थिति में तीव्र गति से होता है।

धनात्मक उत्प्रेरक पर टिप्पणी लिखिए। या धनात्मक उत्प्रेरण क्या है?
उत्तर
वे उत्प्रेरक जो अभिक्रिया के वेग को बढ़ा देते हैं, उन्हें धनात्मक उत्प्रेरक कहते हैं तथा इस घटना को धनात्मक उत्प्रेरण कहते हैं।
उदाहरणार्थ– वनस्पति तेल का वनस्पति घी में हाइड्रोजनीकरण निकिल की उपस्थिति में तीव्र गति से होता है।

प्रश्न 6.
ऋणात्मक उत्प्रेरक पर टिप्पणी लिखिए।
या
ऋणात्मक उत्प्रेरण क्या है? (2013, 16, 17)
उत्तर
जब उत्प्रेरक रासायनिक अभिक्रिया की गति को घटाता है, तो यह घटना ऋणात्मक उत्प्रेरण कहलाती है तथा यह उत्प्रेरक ऋणात्मक उत्प्रेरक कहलाता है।
उदाहरणार्थ- सोडियम सल्फाइट का वायु द्वारा ऑक्सीकरण ग्लिसरीन की उपस्थिति में रुक जाता है; अतः इस अभिक्रिया में ग्लिसरीन ऋणात्मक उत्प्रेरक है।

ऋणात्मक उत्प्रेरक पर टिप्पणी लिखिए।
या
ऋणात्मक उत्प्रेरण क्या है? (2013, 16, 17)
उत्तर
जब उत्प्रेरक रासायनिक अभिक्रिया की गति को घटाता है, तो यह घटना ऋणात्मक उत्प्रेरण कहलाती है तथा यह उत्प्रेरक ऋणात्मक उत्प्रेरक कहलाता है।
उदाहरणार्थ- सोडियम सल्फाइट का वायु द्वारा ऑक्सीकरण ग्लिसरीन की उपस्थिति में रुक जाता है; अतः इस अभिक्रिया में ग्लिसरीन ऋणात्मक उत्प्रेरक है।

प्रश्न 7.
आप उत्प्रेरक उत्साहक (वर्धक) से क्या समझते हैं ? एक उदाहरण द्वारा स्पष्ट कीजिए। (2012, 18)
उत्तर
वे बाहरी पदार्थ जो किसी उत्प्रेरण क्रिया में प्रयुक्त उत्प्रेरक की उत्प्रेरण सक्रियता को बढ़ा देते हैं, किन्तु स्वयं अभिक्रिया के लिए उत्प्रेरक नहीं होते हैं, उत्प्रेरक वर्धक कहलाते हैं।
उदाहरणार्थ– तेलों के हाइड्रोजनीकरण में Ni उत्प्रेरक के लिए Cu उत्प्रेरक वर्धक है।

आप उत्प्रेरक उत्साहक (वर्धक) से क्या समझते हैं ? एक उदाहरण द्वारा स्पष्ट कीजिए। (2012, 18)
उत्तर
वे बाहरी पदार्थ जो किसी उत्प्रेरण क्रिया में प्रयुक्त उत्प्रेरक की उत्प्रेरण सक्रियता को बढ़ा देते हैं, किन्तु स्वयं अभिक्रिया के लिए उत्प्रेरक नहीं होते हैं, उत्प्रेरक वर्धक कहलाते हैं।
उदाहरणार्थ– तेलों के हाइड्रोजनीकरण में Ni उत्प्रेरक के लिए Cu उत्प्रेरक वर्धक है।

प्रश्न 8.
उत्प्रेरक विष क्या है? एक उदाहरण द्वारा व्याख्या कीजिए।
उत्तर
जब कोई बाह्य पदार्थ उत्प्रेरण क्रिया में प्रयुक्त उत्प्रेरक की क्रियाशीलता को कम या नष्ट कर देता है, उत्प्रेरक विष कहलाता है।
उदाहरणार्थ– यदि अमोनिया के बनाने की हेबर विधि में हाइड्रोजन में कार्बन मोनोऑक्साइड उपस्थित हो, तो यह लोहे (जो उत्प्रेरक का कार्य करता है) की क्रियाशीलता को काफी कम कर देती है, अर्थात् CO उत्प्रेरक विष है।

उत्प्रेरक विष क्या है? एक उदाहरण द्वारा व्याख्या कीजिए।
उत्तर
जब कोई बाह्य पदार्थ उत्प्रेरण क्रिया में प्रयुक्त उत्प्रेरक की क्रियाशीलता को कम या नष्ट कर देता है, उत्प्रेरक विष कहलाता है।
उदाहरणार्थ– यदि अमोनिया के बनाने की हेबर विधि में हाइड्रोजन में कार्बन मोनोऑक्साइड उपस्थित हो, तो यह लोहे (जो उत्प्रेरक का कार्य करता है) की क्रियाशीलता को काफी कम कर देती है, अर्थात् CO उत्प्रेरक विष है।

प्रश्न 9.
समांग तथा विषमांग उत्प्रेरण को एक-एक उदाहरण देकर समझाइए। (2013, 16, 17)
उत्तर
समांग उत्प्रेरण– जब अभिकारक तथा उत्प्रेरक एक ही प्रावस्था में होते हैं, तब इस अवस्था को समांग उत्प्रेरण कहते हैं; जैसे –

विषमांग उत्प्रेरण – जब उत्प्रेरक तथा अभिकारक भिन्न प्रावस्था में होते हैं तब यह अवस्था विषमांग उत्प्रेरण कहलाती है; जैसे –

समांग तथा विषमांग उत्प्रेरण को एक-एक उदाहरण देकर समझाइए। (2013, 16, 17)
उत्तर
समांग उत्प्रेरण– जब अभिकारक तथा उत्प्रेरक एक ही प्रावस्था में होते हैं, तब इस अवस्था को समांग उत्प्रेरण कहते हैं; जैसे –
विषमांग उत्प्रेरण – जब उत्प्रेरक तथा अभिकारक भिन्न प्रावस्था में होते हैं तब यह अवस्था विषमांग उत्प्रेरण कहलाती है; जैसे –

प्रश्न 10.
स्वः उत्प्रेरण को उदाहरण सहित स्पष्ट कीजिए। (2012, 15, 16, 18)
उत्तर
ऐसी अभिक्रिया जिसमें अभिक्रिया के फलस्वरूप बना कोई पदार्थ स्वयं उत्प्रेरक का कार्य करने लगता है, स्वः उत्प्रेरक कहलाता है तथा इस घटना को स्वः उत्प्रेरण कहते हैं।
उदाहरणार्थ– एथिल ऐसीटेट के जल-अपघटन के फलस्वरूप बना ऐसीटिक अम्ल स्व: उत्प्रेरक बन जाता है।

स्वः उत्प्रेरण को उदाहरण सहित स्पष्ट कीजिए। (2012, 15, 16, 18)
उत्तर
ऐसी अभिक्रिया जिसमें अभिक्रिया के फलस्वरूप बना कोई पदार्थ स्वयं उत्प्रेरक का कार्य करने लगता है, स्वः उत्प्रेरक कहलाता है तथा इस घटना को स्वः उत्प्रेरण कहते हैं।
उदाहरणार्थ– एथिल ऐसीटेट के जल-अपघटन के फलस्वरूप बना ऐसीटिक अम्ल स्व: उत्प्रेरक बन जाता है।

प्रश्न 11.
प्रेरित उत्प्रेरण को एक उदाहरण द्वारा समझाइए। (2010, 12, 15)
उत्तर
प्रेरित उत्प्रेरण – जब कोई क्रियाशील पदार्थ किसी अक्रियाशील पदार्थ के साथ समान रूप में क्रिया हेतु प्रेरित करके उसको क्रियाशील बना देता है, तो वह क्रियाशील पदार्थ प्रेरित उत्प्रेरक कहलाता है। और यह घटना प्रेरित उत्प्रेरण कहलाती है।
उदाहरणार्थ– सोडियम सल्फाइट (Na2SO3) वायु से ऑक्सीकृत हो जाता है, परन्तु सोडियम आसेंनाइट (Na3AsO3) ऑक्सीकृत नहीं होता है। दोनों को साथ मिलाने पर दोनों ही ऑक्सीकृत हो जाते हैं; क्योंकि सोडियम सल्फाइट का ऑक्सीकरण, सोडियम आसेंनाइट के ऑक्सीकरण को उत्प्रेरित कर देता है; अतः यहाँ सोडियम सल्फाइट प्रेरित उत्प्रेरक का कार्य करता है।

प्रेरित उत्प्रेरण को एक उदाहरण द्वारा समझाइए। (2010, 12, 15)
उत्तर
प्रेरित उत्प्रेरण – जब कोई क्रियाशील पदार्थ किसी अक्रियाशील पदार्थ के साथ समान रूप में क्रिया हेतु प्रेरित करके उसको क्रियाशील बना देता है, तो वह क्रियाशील पदार्थ प्रेरित उत्प्रेरक कहलाता है। और यह घटना प्रेरित उत्प्रेरण कहलाती है।
उदाहरणार्थ– सोडियम सल्फाइट (Na2SO3) वायु से ऑक्सीकृत हो जाता है, परन्तु सोडियम आसेंनाइट (Na3AsO3) ऑक्सीकृत नहीं होता है। दोनों को साथ मिलाने पर दोनों ही ऑक्सीकृत हो जाते हैं; क्योंकि सोडियम सल्फाइट का ऑक्सीकरण, सोडियम आसेंनाइट के ऑक्सीकरण को उत्प्रेरित कर देता है; अतः यहाँ सोडियम सल्फाइट प्रेरित उत्प्रेरक का कार्य करता है।

प्रश्न 12.
उत्प्रेरक से अभिक्रिया की सक्रियण ऊर्जा कम हो जाती है। इस कथन की व्याख्या कीजिए।
उत्तर
किसी अभिक्रिया के लिए सक्रियण ऊर्जा का मान निश्चित और स्थिर होता है, जो अभिक्रिया के ताप या अभिकारकों की सान्द्रता पर निर्भर नहीं करता है। अभिक्रिया की सक्रियण ऊर्जा और उसका वेग स्थिरांक उत्प्रेरक की उपस्थिति से प्रभावित होता है। उत्प्रेरक अभिक्रिया की सक्रियण ऊर्जा को कम कर देता। है और वेग स्थिरांक के मान को बढ़ा देता है, जिससे अभिक्रिया का वेग बढ़ जाता है। उत्प्रेरक की उपस्थिति में अभिक्रिया का नया पथ बन जाता है, जिसमें उत्प्रेरक भाग लेता है। इस नये पथ की सक्रियण ऊर्जा मूल पथ की सक्रियण ऊर्जा से कम होती है।
उत्प्रेरक से अभिक्रिया की सक्रियण ऊर्जा कम हो जाती है। इस कथन की व्याख्या कीजिए।
उत्तर
किसी अभिक्रिया के लिए सक्रियण ऊर्जा का मान निश्चित और स्थिर होता है, जो अभिक्रिया के ताप या अभिकारकों की सान्द्रता पर निर्भर नहीं करता है। अभिक्रिया की सक्रियण ऊर्जा और उसका वेग स्थिरांक उत्प्रेरक की उपस्थिति से प्रभावित होता है। उत्प्रेरक अभिक्रिया की सक्रियण ऊर्जा को कम कर देता। है और वेग स्थिरांक के मान को बढ़ा देता है, जिससे अभिक्रिया का वेग बढ़ जाता है। उत्प्रेरक की उपस्थिति में अभिक्रिया का नया पथ बन जाता है, जिसमें उत्प्रेरक भाग लेता है। इस नये पथ की सक्रियण ऊर्जा मूल पथ की सक्रियण ऊर्जा से कम होती है।
प्रश्न 13.
सूक्ष्म विभाजित अवस्था में उत्प्रेरक, ठोस अवस्था से अधिक क्रियाशील क्यों होते हैं? समझाइए। (2010, 15)
उत्तर
इसका कारण है कि उत्प्रेरक के जितने अधिक टुकड़े होंगे उतनी ही मुक्त संयोजकताएँ अधिक बढ़ेगी, जिनके कारण उसकी कार्यक्षमता अधिक होगी।
सूक्ष्म विभाजित अवस्था में उत्प्रेरक, ठोस अवस्था से अधिक क्रियाशील क्यों होते हैं? समझाइए। (2010, 15)
उत्तर
इसका कारण है कि उत्प्रेरक के जितने अधिक टुकड़े होंगे उतनी ही मुक्त संयोजकताएँ अधिक बढ़ेगी, जिनके कारण उसकी कार्यक्षमता अधिक होगी।
प्रश्न 14.
क्लोरोफॉर्म को रंगीन बोतलों में रखा जाता है तथा उसमें कुछ मात्रा एथिल ऐल्कोहॉल की भी मिलायी जाती है, क्यों? (2009, 12)
उत्तर
क्लोरोफॉर्म को रंगीन बोतल में ऊपर तक भरकर इसलिए रखते हैं जिससे प्रकाश और वायु अन्दर नहीं पहुँच सके, अन्यथा क्लोरोफॉर्म धीरे-धीरे ऑक्सीकृत होकर फॉस्जीन गैस बनाता है जो बहुत तेज विष है। क्लोरोफॉर्म में 1% एथिल ऐल्कोहॉल ऋणात्मक उत्प्रेरक के रूप में डालते हैं। एथिल ऐल्कोहॉल की उपस्थिति से वायु द्वारा क्लोरोफॉर्म के ऑक्सीकरण की गति अत्यन्त धीमी पड़ जाती है।

क्लोरोफॉर्म को रंगीन बोतलों में रखा जाता है तथा उसमें कुछ मात्रा एथिल ऐल्कोहॉल की भी मिलायी जाती है, क्यों? (2009, 12)
उत्तर
क्लोरोफॉर्म को रंगीन बोतल में ऊपर तक भरकर इसलिए रखते हैं जिससे प्रकाश और वायु अन्दर नहीं पहुँच सके, अन्यथा क्लोरोफॉर्म धीरे-धीरे ऑक्सीकृत होकर फॉस्जीन गैस बनाता है जो बहुत तेज विष है। क्लोरोफॉर्म में 1% एथिल ऐल्कोहॉल ऋणात्मक उत्प्रेरक के रूप में डालते हैं। एथिल ऐल्कोहॉल की उपस्थिति से वायु द्वारा क्लोरोफॉर्म के ऑक्सीकरण की गति अत्यन्त धीमी पड़ जाती है।

प्रश्न 15.
एन्जाइम उत्प्रेरकों तथा साधारण उत्प्रेरकों में क्या अन्तर है? एक उदाहरण देकर समझाइए। (2017)
उत्तर
एन्जाइम उत्प्रेरक अभिक्रिया के लिए ताप का एक परिसर होता है जिस पर इनकी क्रियाशीलता अधिकतम होती है। सामान्यत: यह 25 – 35°C के मध्य है। 70°C पर ये निष्क्रिय हो जाते हैं। साधारण उत्प्रेरकों की क्रियाशीलता 70°C के ऊपर ही प्रभावशाली होती है; जैसे- Al2O3 के लिए अनुकूलतम ताप 250°C है।
एन्जाइम उत्प्रेरकों तथा साधारण उत्प्रेरकों में क्या अन्तर है? एक उदाहरण देकर समझाइए। (2017)
उत्तर
एन्जाइम उत्प्रेरक अभिक्रिया के लिए ताप का एक परिसर होता है जिस पर इनकी क्रियाशीलता अधिकतम होती है। सामान्यत: यह 25 – 35°C के मध्य है। 70°C पर ये निष्क्रिय हो जाते हैं। साधारण उत्प्रेरकों की क्रियाशीलता 70°C के ऊपर ही प्रभावशाली होती है; जैसे- Al2O3 के लिए अनुकूलतम ताप 250°C है।
प्रश्न 16.
कोलॉइड क्या हैं? क्रिस्टलाभ से ये किस प्रकार भिन्न हैं? (2010, 12)
उत्तर
कोलॉइड-जो पदार्थ सरलता से जल में नहीं घुलते और घुलने पर समांग विलयन नहीं बनाते तथा जिनके विलयन चर्मपत्र द्वारा नहीं छनते कोलॉइड या कोलॉइडी विलयन कहलाते हैं; जैसे-दूध, मक्खन, दही, बादल, धुआँ, आइसक्रीम, गोंद, सोडियम पामीटेट, रक्त आदि।
क्रिस्टलाभ – जिन पदार्थों के विलयन चर्मपत्र द्वारा छन जाते हैं, क्रिस्टलाभ कहलाते हैं; जैसे- यूरिया, शर्करा, सोडियम प्रोपियोनेट आदि।
कोलॉइड क्या हैं? क्रिस्टलाभ से ये किस प्रकार भिन्न हैं? (2010, 12)
उत्तर
कोलॉइड-जो पदार्थ सरलता से जल में नहीं घुलते और घुलने पर समांग विलयन नहीं बनाते तथा जिनके विलयन चर्मपत्र द्वारा नहीं छनते कोलॉइड या कोलॉइडी विलयन कहलाते हैं; जैसे-दूध, मक्खन, दही, बादल, धुआँ, आइसक्रीम, गोंद, सोडियम पामीटेट, रक्त आदि।
क्रिस्टलाभ – जिन पदार्थों के विलयन चर्मपत्र द्वारा छन जाते हैं, क्रिस्टलाभ कहलाते हैं; जैसे- यूरिया, शर्करा, सोडियम प्रोपियोनेट आदि।
प्रश्न 17.
वास्तविक विलयन तथा कोलॉइडी विलयन में विभेद कीजिए। (2011)
उत्तर
वास्तविक विलयन– यह एक समांग तन्त्र है जिसमें विलेय तथा विलायक के कणों का आकार बराबर होता है। इन कणों का व्यास 10-7 सेमी से भी कम होता है। इन्हें अति सूक्ष्मदर्शी (ultra-microscope) द्वारा भी नहीं देखा जा सकता।
कोलॉइडी विलयन – यह एक विषमांग तन्त्र है, कोलॉइडी विलयन में भिन्न-भिन्न व्यासों के कण उपस्थित होते हैं। इस विलयन में विलेय के कणों का व्यास 10-4 से 10-7 सेमी होता है और विलायक के कणों का व्यास 10-7 से 10-8 सेमी होता है, जिन्हें अति सूक्ष्मदर्शी द्वारा देखा जा सकता है।
वास्तविक विलयन तथा कोलॉइडी विलयन में विभेद कीजिए। (2011)
उत्तर
वास्तविक विलयन– यह एक समांग तन्त्र है जिसमें विलेय तथा विलायक के कणों का आकार बराबर होता है। इन कणों का व्यास 10-7 सेमी से भी कम होता है। इन्हें अति सूक्ष्मदर्शी (ultra-microscope) द्वारा भी नहीं देखा जा सकता।
कोलॉइडी विलयन – यह एक विषमांग तन्त्र है, कोलॉइडी विलयन में भिन्न-भिन्न व्यासों के कण उपस्थित होते हैं। इस विलयन में विलेय के कणों का व्यास 10-4 से 10-7 सेमी होता है और विलायक के कणों का व्यास 10-7 से 10-8 सेमी होता है, जिन्हें अति सूक्ष्मदर्शी द्वारा देखा जा सकता है।
प्रश्न 18.
निलम्बन को परिभाषित कीजिए।
उत्तर
निलम्बन विषमांग तन्त्र होते हैं। इनमें कणों का आकार 1000 nm से अधिक (>10-6 m) होता है। इस तन्त्र के कणों को नेत्रों तथा सूक्ष्मदर्शी दोनों के द्वारा देखा जा सकता है। निलम्बन के कण साधारण फिल्टर पेपर तथा जन्तु झिल्ली दोनों में से किसी में से भी नहीं गुजर पाते हैं। मिट्टी के कणों को जल में डालकर हिलाने पर निलम्बन तन्त्र प्राप्त होता है।
निलम्बन को परिभाषित कीजिए।
उत्तर
निलम्बन विषमांग तन्त्र होते हैं। इनमें कणों का आकार 1000 nm से अधिक (>10-6 m) होता है। इस तन्त्र के कणों को नेत्रों तथा सूक्ष्मदर्शी दोनों के द्वारा देखा जा सकता है। निलम्बन के कण साधारण फिल्टर पेपर तथा जन्तु झिल्ली दोनों में से किसी में से भी नहीं गुजर पाते हैं। मिट्टी के कणों को जल में डालकर हिलाने पर निलम्बन तन्त्र प्राप्त होता है।
प्रश्न 19.
निलम्बन तथा कोलॉइडी विलयन में अन्तर स्पष्ट कीजिए। (2011)
उत्तर
कोलॉइडी विलयन फिल्टर पेपर से विसरित हो जाते हैं जबकि चर्मपत्र, पेपर तथा जन्तु की झिल्लियों से विसरित नहीं होते हैं। इनके कणों पर ऋण या धन आवेश होता है। इसके विपरीत निलम्बन इनमें से किसी से भी विसरित नहीं होते हैं तथा इनके कणों पर कोई आवेश नहीं होता है।
निलम्बन तथा कोलॉइडी विलयन में अन्तर स्पष्ट कीजिए। (2011)
उत्तर
कोलॉइडी विलयन फिल्टर पेपर से विसरित हो जाते हैं जबकि चर्मपत्र, पेपर तथा जन्तु की झिल्लियों से विसरित नहीं होते हैं। इनके कणों पर ऋण या धन आवेश होता है। इसके विपरीत निलम्बन इनमें से किसी से भी विसरित नहीं होते हैं तथा इनके कणों पर कोई आवेश नहीं होता है।
प्रश्न 20.
परिक्षिप्त प्रावस्था तथा परिक्षेपण माध्यम को परिभाषित कीजिए।
उत्तर
वह पदार्थ जो कोलॉइडी कणों के रूप में परिक्षेपण माध्यम में वितरित रहता है, परिक्षिप्त प्रावस्था का निर्माण करता है जबकि वह माध्यम जिसमें पदार्थ कोलॉइडी कणों के रूप में वितरित रहता है, परिक्षेपण माध्यम कहलाता है। अतः कोलॉइडी विलयन = परिक्षिप्त प्रावस्था + परिक्षेपण माध्यम
परिक्षिप्त प्रावस्था तथा परिक्षेपण माध्यम को परिभाषित कीजिए।
उत्तर
वह पदार्थ जो कोलॉइडी कणों के रूप में परिक्षेपण माध्यम में वितरित रहता है, परिक्षिप्त प्रावस्था का निर्माण करता है जबकि वह माध्यम जिसमें पदार्थ कोलॉइडी कणों के रूप में वितरित रहता है, परिक्षेपण माध्यम कहलाता है। अतः कोलॉइडी विलयन = परिक्षिप्त प्रावस्था + परिक्षेपण माध्यम
प्रश्न 21.
द्रव-स्नेही और द्रव-विरोधी कोलॉइड किसे कहते हैं? प्रत्येक को एक-एक उदाहरण सहित समझाइए। (2010, 13, 14, 16, 17)
उत्तर
1. द्रव-स्नेही कोलॉइड – वे कोलॉइडी पदार्थ जो विलायक के सम्पर्क में आकर तुरन्त कोलॉइडी कणों में विभाजित होकर कोलॉइडी विलयन बनाते हैं, द्रव-स्नेही कोलॉइड कहलाते हैं। इनको अवक्षेपित करने के बाद फिर से द्रव के सम्पर्क में लाकर सुगमता से कोलॉइडी विलयन बनाया जा सकता है। इस विशेष गुण के आधार पर इन्हें उत्क्रमणीय कोलॉइड (reversible colloids) कहते हैं। उदाहरणार्थ– जिलेटिन, स्टार्च, गोंद, प्रोटीन आदि।
द्रव-स्नेही और द्रव-विरोधी कोलॉइड किसे कहते हैं? प्रत्येक को एक-एक उदाहरण सहित समझाइए। (2010, 13, 14, 16, 17)
उत्तर
1. द्रव-स्नेही कोलॉइड – वे कोलॉइडी पदार्थ जो विलायक के सम्पर्क में आकर तुरन्त कोलॉइडी कणों में विभाजित होकर कोलॉइडी विलयन बनाते हैं, द्रव-स्नेही कोलॉइड कहलाते हैं। इनको अवक्षेपित करने के बाद फिर से द्रव के सम्पर्क में लाकर सुगमता से कोलॉइडी विलयन बनाया जा सकता है। इस विशेष गुण के आधार पर इन्हें उत्क्रमणीय कोलॉइड (reversible colloids) कहते हैं। उदाहरणार्थ– जिलेटिन, स्टार्च, गोंद, प्रोटीन आदि।
2. द्रव-विरोधी कोलॉइड – वे कोलॉइडी पदार्थ जो विलायक के सम्पर्क में आने पर सरलता से कोलॉइडी विलयन नहीं बनाते हैं, द्रव-विरोधी कोलॉइड कहलाते हैं। इन्हें अवक्षेपित करने के बाद, फिर से कोलॉइडी विलयन में परिवर्तित करना प्राय: कठिन है। अतः ये अनुक्रमणीय कोलॉइड (irreversible colloids) कहलाते हैं। उदाहरणार्थ-धात्विक या धातु ऑक्साइड, धात्विक हाइड्रॉक्साइड [Fe(OH)3], धातु सल्फाइड (As2S3) आदि।
प्रश्न 22.
द्रव-स्नेही तथा द्रव-विरोधी कोलॉइडों में कौन अधिक स्थायी है? दोनों के एक-एक उदाहरण दीजिए। (2015)
उत्तर
द्रव- स्नेही कोलॉइड अधिक स्थायी होते हैं। द्रव-स्नेही कोलॉइड के उदाहरण- गोंद, जिलेटिन आदि। द्रव-विरोधी कोलॉइड फेरिक हाइड्रॉक्साइड Fe (OH)3 सॉल हैं।
द्रव-स्नेही तथा द्रव-विरोधी कोलॉइडों में कौन अधिक स्थायी है? दोनों के एक-एक उदाहरण दीजिए। (2015)
उत्तर
द्रव- स्नेही कोलॉइड अधिक स्थायी होते हैं। द्रव-स्नेही कोलॉइड के उदाहरण- गोंद, जिलेटिन आदि। द्रव-विरोधी कोलॉइड फेरिक हाइड्रॉक्साइड Fe (OH)3 सॉल हैं।
प्रश्न 23.
द्रव स्नेही सॉल, द्रव विरोधी सॉल से अधिक स्थायी क्यों होते हैं? समझाइए। (2017)
उत्तर
द्रव स्नेही सॉल में परिक्षिप्त प्रावस्था और परिक्षेपण माध्यम के अणुओं के मध्य आकर्षण, द्रव विरोधी सॉल की अपेक्षा बहुत अधिक होता है इसलिए द्रव स्नेही सॉल, द्रव विरोधी सॉल की तुलना में
अधिक स्थायी होते हैं।
द्रव स्नेही सॉल, द्रव विरोधी सॉल से अधिक स्थायी क्यों होते हैं? समझाइए। (2017)
उत्तर
द्रव स्नेही सॉल में परिक्षिप्त प्रावस्था और परिक्षेपण माध्यम के अणुओं के मध्य आकर्षण, द्रव विरोधी सॉल की अपेक्षा बहुत अधिक होता है इसलिए द्रव स्नेही सॉल, द्रव विरोधी सॉल की तुलना में
अधिक स्थायी होते हैं।
प्रश्न 24.
द्रव-विरोधी सॉल बनाने की संघनन विधि का वर्णन कीजिए।
उत्तर
संघनन विधि में पदार्थ के लघु अणुओं या आयनों को विभिन्न भौतिक और रासायनिक विधियों द्वारा परस्पर संयुक्त कराकर कोलॉइडी साइज के कण बनाये जाते हैं। एक प्रमुख संघनन विधि ऑक्सीकरण विधि है। उदाहरणार्थ– हाइड्रोजन सल्फाइड गैस (H2S) के जलीय विलयन का सल्फर डाइऑक्साइड द्वारा ऑक्सीकरण करके सल्फर का कोलॉइडी विलयन (सल्फर सॉल) बनाया जा सकता है। |
2H2S + SO2 → 3s + 2H2O
द्रव-विरोधी सॉल बनाने की संघनन विधि का वर्णन कीजिए।
उत्तर
संघनन विधि में पदार्थ के लघु अणुओं या आयनों को विभिन्न भौतिक और रासायनिक विधियों द्वारा परस्पर संयुक्त कराकर कोलॉइडी साइज के कण बनाये जाते हैं। एक प्रमुख संघनन विधि ऑक्सीकरण विधि है। उदाहरणार्थ– हाइड्रोजन सल्फाइड गैस (H2S) के जलीय विलयन का सल्फर डाइऑक्साइड द्वारा ऑक्सीकरण करके सल्फर का कोलॉइडी विलयन (सल्फर सॉल) बनाया जा सकता है। |
2H2S + SO2 → 3s + 2H2O
प्रश्न 25.
सहचारी कोलॉइड या मिसेल से आप क्या समझते हैं?
उत्तर
कुछ पदार्थ ऐसे भी ज्ञात हैं जो कम सान्द्रताओं पर सामान्य प्रबल विद्युत अपघट्य के समान व्यवहार करते हैं परन्तु उच्च सान्द्रताओं पर कणों का पुंज बनने के कारण कोलॉइड के समान व्यवहार करते हैं। इस प्रकार पुंजित कण मिसेल या सहचारी कोलॉइड कहलाते हैं।
सहचारी कोलॉइड या मिसेल से आप क्या समझते हैं?
उत्तर
कुछ पदार्थ ऐसे भी ज्ञात हैं जो कम सान्द्रताओं पर सामान्य प्रबल विद्युत अपघट्य के समान व्यवहार करते हैं परन्तु उच्च सान्द्रताओं पर कणों का पुंज बनने के कारण कोलॉइड के समान व्यवहार करते हैं। इस प्रकार पुंजित कण मिसेल या सहचारी कोलॉइड कहलाते हैं।
प्रश्न 26.
आर्सेनियस सल्फाइड का शुद्ध कोलॉइडी विलयन किस प्रकार प्राप्त किया जाता है? समीकरण भी दीजिए। (2013)
उत्तर
आर्सेनियस सल्फाइड का सॉल उभय-अपघटन विधि से तैयार किया जाता है। आर्सेनियस ऑक्साइड (As2O3) के ठण्डे जलीय विलयन में धीरे-धीरे H2S गैस आधिक्य में प्रवाहित करने से आर्सेनियस सल्फाइड (As2S3) का पीला सॉल प्राप्त होता है।

आर्सेनियस सल्फाइड का शुद्ध कोलॉइडी विलयन किस प्रकार प्राप्त किया जाता है? समीकरण भी दीजिए। (2013)
उत्तर
आर्सेनियस सल्फाइड का सॉल उभय-अपघटन विधि से तैयार किया जाता है। आर्सेनियस ऑक्साइड (As2O3) के ठण्डे जलीय विलयन में धीरे-धीरे H2S गैस आधिक्य में प्रवाहित करने से आर्सेनियस सल्फाइड (As2S3) का पीला सॉल प्राप्त होता है।
प्रश्न 27.
कोलॉइडी विलयनों (सॉल) के शुद्धिकरण की अतिसूक्ष्म निस्यन्दन विधि को समझाइए।
उत्तर
सामान्य फिल्टर पेपर (filter paper) के छिद्रों का आकार बड़ा होता है। इस कारण उससे अशुद्धि कण तथा कोलॉइडी कण आसानी से पार हो जाते हैं। अतः अशुद्ध सॉल से वैद्युत अपघट्य की अशुद्धियों को दूर करने के लिये सामान्य फिल्टर पेपर का उपयोग नहीं किया जा सकता है। लेकिन यदि सामान्य फिल्टर पेपर के छिद्रों का आकार छोटा कर दिया जाये तो अशुद्ध सॉल से अशुद्धियों को अलग करने में इसका उपयोग किया जा सकता है। इसके लिये साधारण फिल्टर पेपर को जिलेटिन या कोलोडिओन (collodion) से लेपित करने के पश्चात् फॉर्मेल्डीहाइड में डुबोया जाता है। प्रयुक्त कोलोडिओन विलयन ऐल्कोहॉल तथा ईथर के मिश्रण में नाइट्रोसेलुलोज (nitrocellulose) का 4% विलयन होता है। इस प्रकार प्राप्त फिल्टर पेपरों को अति सूक्ष्म फिल्टर (ultra filters) कहते हैं तथा इनके द्वारा अशुद्ध कोलॉइडी विलयन या सॉल को छानने के प्रक्रम को अतिसूक्ष्म नियंदन (ultrafiltration) कहते हैं।
कोलॉइडी विलयनों (सॉल) के शुद्धिकरण की अतिसूक्ष्म निस्यन्दन विधि को समझाइए।
उत्तर
सामान्य फिल्टर पेपर (filter paper) के छिद्रों का आकार बड़ा होता है। इस कारण उससे अशुद्धि कण तथा कोलॉइडी कण आसानी से पार हो जाते हैं। अतः अशुद्ध सॉल से वैद्युत अपघट्य की अशुद्धियों को दूर करने के लिये सामान्य फिल्टर पेपर का उपयोग नहीं किया जा सकता है। लेकिन यदि सामान्य फिल्टर पेपर के छिद्रों का आकार छोटा कर दिया जाये तो अशुद्ध सॉल से अशुद्धियों को अलग करने में इसका उपयोग किया जा सकता है। इसके लिये साधारण फिल्टर पेपर को जिलेटिन या कोलोडिओन (collodion) से लेपित करने के पश्चात् फॉर्मेल्डीहाइड में डुबोया जाता है। प्रयुक्त कोलोडिओन विलयन ऐल्कोहॉल तथा ईथर के मिश्रण में नाइट्रोसेलुलोज (nitrocellulose) का 4% विलयन होता है। इस प्रकार प्राप्त फिल्टर पेपरों को अति सूक्ष्म फिल्टर (ultra filters) कहते हैं तथा इनके द्वारा अशुद्ध कोलॉइडी विलयन या सॉल को छानने के प्रक्रम को अतिसूक्ष्म नियंदन (ultrafiltration) कहते हैं।
प्रश्न 28.
गॅदले पानी को साफ करने के लिए फिटकरी का प्रयोग क्यों किया जाता है? (2012)
उत्तर
आँदले पानी में मिट्टी, रेत आदि की अशुद्धियाँ कोलॉइडी कणों के रूप में उपस्थित रहती हैं। ये कोलॉइडी कण ऋणावेशित होते हैं। कोलॉइडी कणों की अशुद्धि दूर करने के लिए जल में फिटकरी (पोटाशएलम) डाली जाती है। फिटकरी [K2SO4 . Al2(SO4)3 . 24H2O] जल में घुलकर K+ , Al3+ तथा SO2-4 आयनों में वियोजित हो जाती है। K+ और Al3+ द्वारा ऋणावेशित कणों का स्कन्दन हो जाता है। और वे जल में नीचे बैठ जाते हैं। इस प्रकार गॅदला पानी साफ हो जाता है।
गॅदले पानी को साफ करने के लिए फिटकरी का प्रयोग क्यों किया जाता है? (2012)
उत्तर
आँदले पानी में मिट्टी, रेत आदि की अशुद्धियाँ कोलॉइडी कणों के रूप में उपस्थित रहती हैं। ये कोलॉइडी कण ऋणावेशित होते हैं। कोलॉइडी कणों की अशुद्धि दूर करने के लिए जल में फिटकरी (पोटाशएलम) डाली जाती है। फिटकरी [K2SO4 . Al2(SO4)3 . 24H2O] जल में घुलकर K+ , Al3+ तथा SO2-4 आयनों में वियोजित हो जाती है। K+ और Al3+ द्वारा ऋणावेशित कणों का स्कन्दन हो जाता है। और वे जल में नीचे बैठ जाते हैं। इस प्रकार गॅदला पानी साफ हो जाता है।
प्रश्न 29.
धुएँ से कार्बन के कणों को किस प्रकार पृथक करते हैं ? (2012)
उत्तर
धुएँ को कार्बन के कोलॉइडी कणों से मुक्त करने के लिए कॉटेल धुआँ अवक्षेपक प्रयुक्त किया जाता है। इस अवक्षेपक में एक स्तम्भ में धातु का एक गोला लटका रहता है जिसे उच्च वोल्टता पर धनावेशित किया जाता है। धुएँ को अवक्षेपक में से प्रवाहित करने पर उसमें उपस्थित कार्बन के ऋणावेशित कोलॉइडी कण धनावेशित गोले के सम्पर्क में आकर निरावेशित हो जाते हैं और विद्युत उदासीन कण एक-दूसरे से मिलकर अवक्षेप के रूप में नीचे बैठ जाते हैं तथा कार्बन-कणों से मुक्त वायु बाहर निकल जाती है।
धुएँ से कार्बन के कणों को किस प्रकार पृथक करते हैं ? (2012)
उत्तर
धुएँ को कार्बन के कोलॉइडी कणों से मुक्त करने के लिए कॉटेल धुआँ अवक्षेपक प्रयुक्त किया जाता है। इस अवक्षेपक में एक स्तम्भ में धातु का एक गोला लटका रहता है जिसे उच्च वोल्टता पर धनावेशित किया जाता है। धुएँ को अवक्षेपक में से प्रवाहित करने पर उसमें उपस्थित कार्बन के ऋणावेशित कोलॉइडी कण धनावेशित गोले के सम्पर्क में आकर निरावेशित हो जाते हैं और विद्युत उदासीन कण एक-दूसरे से मिलकर अवक्षेप के रूप में नीचे बैठ जाते हैं तथा कार्बन-कणों से मुक्त वायु बाहर निकल जाती है।
प्रश्न 30.
ठोस ऐरोसॉल क्या है? एक उदाहरण दीजिए। (2011)
उत्तर
जब परिक्षिप्त अवस्था ठोस तथा परिक्षेपण माध्यम गैस होता है तो उस कोलॉइडी विलयन को ठोस ऐरोसॉल कहते हैं; जैसे-धुआँ, ज्वालामुखी का लावा आदि।
ठोस ऐरोसॉल क्या है? एक उदाहरण दीजिए। (2011)
उत्तर
जब परिक्षिप्त अवस्था ठोस तथा परिक्षेपण माध्यम गैस होता है तो उस कोलॉइडी विलयन को ठोस ऐरोसॉल कहते हैं; जैसे-धुआँ, ज्वालामुखी का लावा आदि।
प्रश्न 31.
कोलॉइडी अवस्था में औषधियाँ अधिक प्रभावी क्यों होती हैं? समझाइए। (2011)
उत्तर
कोलॉइडी अवस्था में औषधियाँ अधिक प्रभावी इसलिए होती हैं, क्योंकि इस अवस्था में औषधियों का अवशोषण अधिक सुगमता से होता है।
कोलॉइडी अवस्था में औषधियाँ अधिक प्रभावी क्यों होती हैं? समझाइए। (2011)
उत्तर
कोलॉइडी अवस्था में औषधियाँ अधिक प्रभावी इसलिए होती हैं, क्योंकि इस अवस्था में औषधियों का अवशोषण अधिक सुगमता से होता है।
प्रश्न 32.
धुएँ में परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम लिखिए। (2012)
उत्तर
परिक्षिप्त प्रावस्था ठोस, परिक्षेपण माध्यम गैस।
धुएँ में परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम लिखिए। (2012)
उत्तर
परिक्षिप्त प्रावस्था ठोस, परिक्षेपण माध्यम गैस।
प्रश्न 33.
किसी वैद्युत-अपघट्य का ऊर्णन मान क्या है? समझाइए। (2016)
उत्तर
किसी आयन का मिली मोल में वह कम-से-कम सान्द्रण जो एक लीटर सॉल को स्कन्दित करने हेतु पर्याप्त हो, उसका ऊर्णन मान कहलाता है। जितनी कम मात्रा किसी वैद्युत-अपघट्य की आवश्यक होती है, उतनी ही अधिक उसकी स्कन्दन शक्ति होती है। अतः

किसी वैद्युत-अपघट्य का ऊर्णन मान क्या है? समझाइए। (2016)
उत्तर
किसी आयन का मिली मोल में वह कम-से-कम सान्द्रण जो एक लीटर सॉल को स्कन्दित करने हेतु पर्याप्त हो, उसका ऊर्णन मान कहलाता है। जितनी कम मात्रा किसी वैद्युत-अपघट्य की आवश्यक होती है, उतनी ही अधिक उसकी स्कन्दन शक्ति होती है। अतः

प्रश्न 34.
आर्सेनियस सल्फाइड सॉल के स्कन्दन के लिए निम्नलिखित को उनकी घटती हुई स्कन्दन क्षमता के क्रम में लिखिए –
KCl, AlCl3, Na3PO4 , Mg(NO3)2
उत्तर
आर्सेनियस सल्फाइड सॉल एक ऋणात्मक सॉल है जिसको स्कन्दित करने में वैद्युत-अपघट्य के धनायन प्रयुक्त होंगे; अत: हार्डी-शुल्जे के नियमानुसार इन वैद्युत-अपघट्यों के द्वारा स्कन्दन क्षमता का घटता क्रम है –
AlCl3 > Mg(NO3)2 > KCl > Na3PO4
आर्सेनियस सल्फाइड सॉल के स्कन्दन के लिए निम्नलिखित को उनकी घटती हुई स्कन्दन क्षमता के क्रम में लिखिए –
KCl, AlCl3, Na3PO4 , Mg(NO3)2
उत्तर
आर्सेनियस सल्फाइड सॉल एक ऋणात्मक सॉल है जिसको स्कन्दित करने में वैद्युत-अपघट्य के धनायन प्रयुक्त होंगे; अत: हार्डी-शुल्जे के नियमानुसार इन वैद्युत-अपघट्यों के द्वारा स्कन्दन क्षमता का घटता क्रम है –
AlCl3 > Mg(NO3)2 > KCl > Na3PO4
प्रश्न 35.
नदी तथा समुद्र के मिलन बिन्दु पर डेल्टा बनने का कारण बताइए। (2015)
उत्तर
नदी के जल में मिट्टी, रेत आदि कोलॉइडी विलयन के रूप में उपस्थित रहते हैं, क्योंकि जल में रेत (SiO2) परिक्षिप्त रहता है, जबकि समुद्री जल में NaCl जैसे लवण विलेय रहते हैं, जो वैद्युत-अपघट्य हैं। इन जलों के मिलन बिन्दु पर समुद्र के NaCl द्वारा नदी के कोलॉइड कणों का स्कन्दन (अवक्षेपण) हो जाता है, जिससे मिट्टी, रेत आदि एकत्र होकर डेल्टा का निर्माण कर देते हैं।
नदी तथा समुद्र के मिलन बिन्दु पर डेल्टा बनने का कारण बताइए। (2015)
उत्तर
नदी के जल में मिट्टी, रेत आदि कोलॉइडी विलयन के रूप में उपस्थित रहते हैं, क्योंकि जल में रेत (SiO2) परिक्षिप्त रहता है, जबकि समुद्री जल में NaCl जैसे लवण विलेय रहते हैं, जो वैद्युत-अपघट्य हैं। इन जलों के मिलन बिन्दु पर समुद्र के NaCl द्वारा नदी के कोलॉइड कणों का स्कन्दन (अवक्षेपण) हो जाता है, जिससे मिट्टी, रेत आदि एकत्र होकर डेल्टा का निर्माण कर देते हैं।
प्रश्न 36.
आर्सेनियस सल्फाइडे सॉल में फेरिक हाइड्रॉक्साइड का सॉल मिलाने पर दोनों का अवक्षेपण हो जाता है। समझाइए क्यों ?
उत्तर
दो विपरीत आवेशित द्रव-विरोधी सॉलों को परस्पर उचित अनुपात में मिलाने पर दोनों सॉल एक-दूसरे को अवक्षेपित कर देते हैं। इसे सॉलों का पारस्परिक स्कन्दन कहते हैं। इसीलिए ऋणावेशित
आर्सेनियस सल्फाइड सॉल और धनावेशित फेरिक हाइड्रॉक्साइड सॉल को मिलाने पर आर्सेनियस सल्फाइड तथा फेरिक हाइड्रॉक्साइड दोनों कोलॉइड एक साथ अवक्षेपित या स्कन्दित हो जाते हैं।
आर्सेनियस सल्फाइडे सॉल में फेरिक हाइड्रॉक्साइड का सॉल मिलाने पर दोनों का अवक्षेपण हो जाता है। समझाइए क्यों ?
उत्तर
दो विपरीत आवेशित द्रव-विरोधी सॉलों को परस्पर उचित अनुपात में मिलाने पर दोनों सॉल एक-दूसरे को अवक्षेपित कर देते हैं। इसे सॉलों का पारस्परिक स्कन्दन कहते हैं। इसीलिए ऋणावेशित
आर्सेनियस सल्फाइड सॉल और धनावेशित फेरिक हाइड्रॉक्साइड सॉल को मिलाने पर आर्सेनियस सल्फाइड तथा फेरिक हाइड्रॉक्साइड दोनों कोलॉइड एक साथ अवक्षेपित या स्कन्दित हो जाते हैं।
प्रश्न 37.
आर्सेनियस सल्फाइड सॉल को स्कन्दित करने में AlCl3 का 0.1 M घोल, Na3PO4 के 0.1 M घोल की अपेक्षा अधिक प्रभावशाली होता है, परन्तु फेरिक हाइड्रॉक्साइड सॉल को स्कन्दित करने में Alcl3 का 0.1 M घोल Na3PO4 के 0.1 M घोल की अपेक्षा कम प्रभावशाली होता है, क्यों ? कारण समझाइए। (2011, 13)
उत्तर
किसी कोलॉइडी विलयन का अवक्षेपण करने में विद्युत अपघट्य का वह आयन प्रभावी होता है। जिस पर कोलॉइडी कणों से विपरीत आवेश होता है तथा प्रभावी आयन की संयोजकता बढ़ने से प्रभावी
आयन की स्कन्दन शक्ति बढ़ती है।
आर्सेनियस सल्फाइड सॉल को स्कन्दित करने में AlCl3 का 0.1 M घोल, Na3PO4 के 0.1 M घोल की अपेक्षा अधिक प्रभावशाली होता है, परन्तु फेरिक हाइड्रॉक्साइड सॉल को स्कन्दित करने में Alcl3 का 0.1 M घोल Na3PO4 के 0.1 M घोल की अपेक्षा कम प्रभावशाली होता है, क्यों ? कारण समझाइए। (2011, 13)
उत्तर
किसी कोलॉइडी विलयन का अवक्षेपण करने में विद्युत अपघट्य का वह आयन प्रभावी होता है। जिस पर कोलॉइडी कणों से विपरीत आवेश होता है तथा प्रभावी आयन की संयोजकता बढ़ने से प्रभावी
आयन की स्कन्दन शक्ति बढ़ती है।
इसलिए आसेंनियस सल्फाइड के ऋणावेशित कोलॉइडी कणों के स्कन्दन में Na3PO4 के Na+ आयन की अपेक्षा AlCl3 के Al3+आयन अधिक प्रभावी होते हैं जबकि फेरिक हाइड्रॉक्साइड के धनावेशित कोलॉइडी कणों [Fe(OH)3] Fe3+ के स्कन्दन में AlCl3 के Cl– आयन, Na3PO4 के PO3-4 आयन की अपेक्षा कम प्रभावी होते हैं।
प्रश्न 38.
रक्षी कोलॉइड क्या हैं? एक उदाहरण दीजिए। (2009, 11, 13, 16, 17)
उत्तर
जब किसी द्रव-विरोधी कोलॉइडी विलयन में वैद्युत-अपघट्य का विलयन मिलाने से पूर्व द्रव-स्नेही कोलॉइडी विलयन की कुछ मात्रा को डाला जाता है, तो द्रव-विरोधी कोलॉइड का स्कन्दन रुक जाता है अर्थात् उसका स्थायित्व बढ़ जाता है। यह प्रक्रम रक्षण(protection) कहलाता है। वे द्रव-स्नेही कोलॉइड, जिन्हें डालने पर द्रव-विरोधी कोलॉइडों का स्कन्दन से स्थायित्व बढ़ जाता है, रक्षी कोलॉइड कहलाते हैं और इस प्रकार प्राप्त द्रव-विरोधी कोलॉइडी विलयन, रक्षित (रक्षी ) कोलॉइड कहलाते हैं; जैसे—गोल्ड के कोलॉइडी विलयन में यदि सोडियम क्लोराइड का विलयन मिला दिया जाए तो यह स्कन्दित हो जाता है, किन्तु इस कोलॉइडी विलयन में यदि जिलेटिन की अल्प- मात्रा डाल दी जाए तो NaCl विलयन द्वारा स्कन्दन रुक जाता है। इस प्रकार जिलेटिन यहाँ एक रक्षी कोलॉइड के रूप में कार्य करता है।
रक्षी कोलॉइड क्या हैं? एक उदाहरण दीजिए। (2009, 11, 13, 16, 17)
उत्तर
जब किसी द्रव-विरोधी कोलॉइडी विलयन में वैद्युत-अपघट्य का विलयन मिलाने से पूर्व द्रव-स्नेही कोलॉइडी विलयन की कुछ मात्रा को डाला जाता है, तो द्रव-विरोधी कोलॉइड का स्कन्दन रुक जाता है अर्थात् उसका स्थायित्व बढ़ जाता है। यह प्रक्रम रक्षण(protection) कहलाता है। वे द्रव-स्नेही कोलॉइड, जिन्हें डालने पर द्रव-विरोधी कोलॉइडों का स्कन्दन से स्थायित्व बढ़ जाता है, रक्षी कोलॉइड कहलाते हैं और इस प्रकार प्राप्त द्रव-विरोधी कोलॉइडी विलयन, रक्षित (रक्षी ) कोलॉइड कहलाते हैं; जैसे—गोल्ड के कोलॉइडी विलयन में यदि सोडियम क्लोराइड का विलयन मिला दिया जाए तो यह स्कन्दित हो जाता है, किन्तु इस कोलॉइडी विलयन में यदि जिलेटिन की अल्प- मात्रा डाल दी जाए तो NaCl विलयन द्वारा स्कन्दन रुक जाता है। इस प्रकार जिलेटिन यहाँ एक रक्षी कोलॉइड के रूप में कार्य करता है।
प्रश्न 39.
स्वर्ण संख्या या स्वर्णाक की परिभाषा दीजिए। (2009, 10, 11, 12, 15, 16, 18)
उत्तर
रक्षी कोलॉइड की शक्ति को स्वर्ण संख्या (gold number) से व्यक्त किया जाता है। स्वर्ण संख्या की परिभाषा निम्न प्रकार से दी जाती है –
किसी द्रव-स्नेही कोलॉइड की स्वर्ण संख्या उसका मिलीग्राम में वह भार है जो गोल्ड सॉल के 10 मिली में उपस्थित होने पर 10% NaCl विलयन के 1 मिली को डालने पर सॉल के लाल रंग से नीले रंग में परिवर्तित होने को रोकने के लिए पर्याप्त होता है।”
स्वर्ण संख्या, रक्षी सॉल की शक्ति व्यक्त करने का प्रतीक है। स्वर्ण संख्या जितनी अधिक होगी, सॉल की स्कन्दन शक्ति उतनी ही कम होगी। कम स्वर्ण संख्या होने पर सॉल की स्कन्दन शक्ति अधिक होगी।
स्वर्ण संख्या या स्वर्णाक की परिभाषा दीजिए। (2009, 10, 11, 12, 15, 16, 18)
उत्तर
रक्षी कोलॉइड की शक्ति को स्वर्ण संख्या (gold number) से व्यक्त किया जाता है। स्वर्ण संख्या की परिभाषा निम्न प्रकार से दी जाती है –
किसी द्रव-स्नेही कोलॉइड की स्वर्ण संख्या उसका मिलीग्राम में वह भार है जो गोल्ड सॉल के 10 मिली में उपस्थित होने पर 10% NaCl विलयन के 1 मिली को डालने पर सॉल के लाल रंग से नीले रंग में परिवर्तित होने को रोकने के लिए पर्याप्त होता है।”
स्वर्ण संख्या, रक्षी सॉल की शक्ति व्यक्त करने का प्रतीक है। स्वर्ण संख्या जितनी अधिक होगी, सॉल की स्कन्दन शक्ति उतनी ही कम होगी। कम स्वर्ण संख्या होने पर सॉल की स्कन्दन शक्ति अधिक होगी।
प्रश्न 40.
जिलेटिन व गोंद के स्वर्णाक क्रमशः 0.005 तथा 0.10 हैं। इन रक्षी कोलॉइडों में किसकी रक्षी क्षमता अधिक है?
उत्तर
रक्षी कोलॉइडों की रक्षी क्रिया उनका स्वर्णाक घटने के साथ बढ़ती है, अर्थात् एक अच्छे रक्षी कोलॉइड का स्वर्णाक कम होता है। अतः जिलेटिन की रक्षी क्षमता अधिक होगी।
जिलेटिन व गोंद के स्वर्णाक क्रमशः 0.005 तथा 0.10 हैं। इन रक्षी कोलॉइडों में किसकी रक्षी क्षमता अधिक है?
उत्तर
रक्षी कोलॉइडों की रक्षी क्रिया उनका स्वर्णाक घटने के साथ बढ़ती है, अर्थात् एक अच्छे रक्षी कोलॉइड का स्वर्णाक कम होता है। अतः जिलेटिन की रक्षी क्षमता अधिक होगी।
प्रश्न 41.
गोल्ड सॉल के 10 मिली में 10% NaCl विलयन का 1 मिली डालने से पहले 0.025 ग्राम स्टार्च मिला देने से उसका स्कन्दन पूर्णतया रुक जाता है। स्टार्च की गोल्ड संख्या बताइए। (2009)
उत्तर
0.025.
गोल्ड सॉल के 10 मिली में 10% NaCl विलयन का 1 मिली डालने से पहले 0.025 ग्राम स्टार्च मिला देने से उसका स्कन्दन पूर्णतया रुक जाता है। स्टार्च की गोल्ड संख्या बताइए। (2009)
उत्तर
0.025.
प्रश्न 42.
जिलेटिन की स्वर्ण संख्या 0.005 है। इसका क्या तात्पर्य है?
उत्तर
इसका तात्पर्य है कि जिलेटिन की 0.005 मिलीग्राम मात्रा 10 मिली गोल्ड के कोलॉइडी विलयन का NaCl के 10% सान्द्रता के 1 मिली विलयन द्वारा स्कन्दन रोकती है।
जिलेटिन की स्वर्ण संख्या 0.005 है। इसका क्या तात्पर्य है?
उत्तर
इसका तात्पर्य है कि जिलेटिन की 0.005 मिलीग्राम मात्रा 10 मिली गोल्ड के कोलॉइडी विलयन का NaCl के 10% सान्द्रता के 1 मिली विलयन द्वारा स्कन्दन रोकती है।
प्रश्न 43.
पेप्टीकरण की क्रिया को एक उदाहरण द्वारा समझाइए। (2009, 12, 18)
उत्तर
पेप्टीकरण– पेप्टीकरण की विधि स्कन्दन के विपरीत है। इसमें ताजे बने हुए अवक्षेप को किसी वैद्युत-अपघट्य के तनु विलयन के साथ हिलाने पर कोलॉइडी विलयन प्राप्त होता है; जैसे- फेरिक हाइड्रॉक्साइड के ताजे अवक्षेप में फेरिक क्लोराइड का विलयन मिलाने पर लाल रंग का Fe(OH)3 का कोलॉइडी विलयन बनता है।
पेप्टीकरण की क्रिया को एक उदाहरण द्वारा समझाइए। (2009, 12, 18)
उत्तर
पेप्टीकरण– पेप्टीकरण की विधि स्कन्दन के विपरीत है। इसमें ताजे बने हुए अवक्षेप को किसी वैद्युत-अपघट्य के तनु विलयन के साथ हिलाने पर कोलॉइडी विलयन प्राप्त होता है; जैसे- फेरिक हाइड्रॉक्साइड के ताजे अवक्षेप में फेरिक क्लोराइड का विलयन मिलाने पर लाल रंग का Fe(OH)3 का कोलॉइडी विलयन बनता है।
प्रश्न 44.
कासियस-पर्पिल क्या है? आप इसे कैसे प्राप्त करेंगे? (2013, 18)
उत्तर
ऑरिक क्लोराइड विलयन का स्टैनस क्लोराइड विलयन द्वारा अपचयन करने पर बैंगनी रंग का गोल्ड सॉल बनता है, जिसे कासियस-पर्पिल कहते हैं।
2AuCl3 + 3SnCl2 → 2Au + 3SnCl4
SnCl4 + 2H2O → SnO2 + 4HCl
कासियस-पर्पिल क्या है? आप इसे कैसे प्राप्त करेंगे? (2013, 18)
उत्तर
ऑरिक क्लोराइड विलयन का स्टैनस क्लोराइड विलयन द्वारा अपचयन करने पर बैंगनी रंग का गोल्ड सॉल बनता है, जिसे कासियस-पर्पिल कहते हैं।
2AuCl3 + 3SnCl2 → 2Au + 3SnCl4
SnCl4 + 2H2O → SnO2 + 4HCl
प्रश्न 45.
गोल्ड सॉल बनाने की ब्रेडिग आर्क विधि का वर्णन कीजिए। (2014)
उत्तर
इस विधि में परिक्षेपण तथा संघनन दोनों क्रियाएँ होती हैं। धातु (गोल्ड) के दो इलेक्ट्रोडों को NaOH की अल्प मात्रा युक्त ठण्डे जल (परिक्षेपण माध्यम) में डुबोकर धातु इलेक्ट्रोडों के बीच विद्युत आर्क उत्पन्न किया जाता है जिससे धातु वाष्पित होती है और ठण्डा करने पर कोलॉइड आकार के कणों में परिवर्तित हो जाती है जिससे गोल्ड सॉल बन जाता है।
गोल्ड सॉल बनाने की ब्रेडिग आर्क विधि का वर्णन कीजिए। (2014)
उत्तर
इस विधि में परिक्षेपण तथा संघनन दोनों क्रियाएँ होती हैं। धातु (गोल्ड) के दो इलेक्ट्रोडों को NaOH की अल्प मात्रा युक्त ठण्डे जल (परिक्षेपण माध्यम) में डुबोकर धातु इलेक्ट्रोडों के बीच विद्युत आर्क उत्पन्न किया जाता है जिससे धातु वाष्पित होती है और ठण्डा करने पर कोलॉइड आकार के कणों में परिवर्तित हो जाती है जिससे गोल्ड सॉल बन जाता है।
प्रश्न 46.
नैनो पदार्थ किसे कहते हैं? (2017)
उत्तर
ऐसे पदार्थ जिनका आकार 1 से 100 नैनो (अर्थात् 1 से 100 नैनोमीटर पैमाने) के अन्तर्गत होता है, नैनो पदार्थ कहलाते हैं।
नैनो पदार्थ किसे कहते हैं? (2017)
उत्तर
ऐसे पदार्थ जिनका आकार 1 से 100 नैनो (अर्थात् 1 से 100 नैनोमीटर पैमाने) के अन्तर्गत होता है, नैनो पदार्थ कहलाते हैं।
लघु उत्तरीय प्रश्न
प्रश्न 1.
एक उदाहरण देकर उत्प्रेरक के माध्यमिक यौगिक निर्माण सिद्धान्त को समझाइए।
उत्तर
माध्यमिक यौगिक निर्माण सिद्धान्त को सन् 1806 में क्लीमेन्ट तथा डीसोरम्स (Clement and Desormes) ने प्रतिपादित किया था। इस सिद्धान्त के अनुसार उत्प्रेरक किसी एक अभिकारक के साथ क्रिया करके निम्न सक्रियण ऊर्जा वाला एक वैकल्पिक मार्ग प्रदान करता है।
एक उदाहरण देकर उत्प्रेरक के माध्यमिक यौगिक निर्माण सिद्धान्त को समझाइए।
उत्तर
माध्यमिक यौगिक निर्माण सिद्धान्त को सन् 1806 में क्लीमेन्ट तथा डीसोरम्स (Clement and Desormes) ने प्रतिपादित किया था। इस सिद्धान्त के अनुसार उत्प्रेरक किसी एक अभिकारक के साथ क्रिया करके निम्न सक्रियण ऊर्जा वाला एक वैकल्पिक मार्ग प्रदान करता है।
इस सिद्धान्त के अनुसार उत्प्रेरक किसी एक अभिकारक के साथ रासायनिक संयोग करके एक अस्थायी माध्यमिक यौगिक (intermediate compound) बनाता है। वास्तविक अभिक्रिया की तुलना में माध्यमिक यौगिक का निर्माण निम्न ऊर्जा अवरोध का मार्ग प्रदान करता है। माध्यमिक यौगिक बहुत अस्थायी होता है तथा यह माध्यमिक यौगिक दूसरे अभिकारक से क्रिया करके अभीष्ट उत्पाद बनाता है। इस प्रकार से अभिक्रिया उत्प्रेरित हो जाती है।
लैड चैम्बर विधि द्वारा सल्फ्यूरिक अम्ल के निर्माण में नाइट्रिक अम्ल उत्प्रेरक की भाँति प्रयुक्त होता है।
2SO2 +O2 2SO3
2SO3
यह माना जाता है कि अभिक्रिया माध्यमिक यौगिक NO2 के निर्माण द्वारा होती है।

लैड चैम्बर विधि द्वारा सल्फ्यूरिक अम्ल के निर्माण में नाइट्रिक अम्ल उत्प्रेरक की भाँति प्रयुक्त होता है।
2SO2 +O2
यह माना जाता है कि अभिक्रिया माध्यमिक यौगिक NO2 के निर्माण द्वारा होती है।

प्रश्न 2.
अधिशोषण सिद्धान्त के आधार पर ठोस उत्प्रेरक की क्रियाशीलता को समझाइए। (2009, 11)
उत्तर
इस सिद्धान्त के अनुसार, ठोस उत्प्रेरक अभिकारकों को अपनी सतह पर अधिशोषित कर लेता है। जिससे इनका ठोस की सतह पर सान्द्रण बढ़ जाता है और द्रव्य-अनुपाती क्रिया के नियमानुसार अभिक्रिया का वेग बढ़ जाता है, परन्तु यह सिद्धान्त इस दृष्टि से अपूर्ण है, कि इससे गैस तथा द्रव उत्प्रेरकों के प्रभाव को नहीं समझाया जा सकता। अत: इसका आधुनिक रूप निम्न प्रकार है –
आधुनिक अधिशोषण सिद्धान्त – आधुनिक सिद्धान्त, माध्यमिक यौगिक सिद्धान्त तथा अधिशोषण सिद्धान्त का संयुक्त रूप है।
उदाहरणार्थ– जब वनस्पति तेलों में हाइड्रोजन गैस निकिल उत्प्रेरक की उपस्थिति में प्रवाहित की जाती है। तो तेलों को हाइड्रोजनीकरण होता है और वनस्पति घी बनता है। Ni उत्प्रेरक की क्रियाविधि को निम्न प्रकार समझाया जा सकता है –
अधिशोषण सिद्धान्त के आधार पर ठोस उत्प्रेरक की क्रियाशीलता को समझाइए। (2009, 11)
उत्तर
इस सिद्धान्त के अनुसार, ठोस उत्प्रेरक अभिकारकों को अपनी सतह पर अधिशोषित कर लेता है। जिससे इनका ठोस की सतह पर सान्द्रण बढ़ जाता है और द्रव्य-अनुपाती क्रिया के नियमानुसार अभिक्रिया का वेग बढ़ जाता है, परन्तु यह सिद्धान्त इस दृष्टि से अपूर्ण है, कि इससे गैस तथा द्रव उत्प्रेरकों के प्रभाव को नहीं समझाया जा सकता। अत: इसका आधुनिक रूप निम्न प्रकार है –
आधुनिक अधिशोषण सिद्धान्त – आधुनिक सिद्धान्त, माध्यमिक यौगिक सिद्धान्त तथा अधिशोषण सिद्धान्त का संयुक्त रूप है।
उदाहरणार्थ– जब वनस्पति तेलों में हाइड्रोजन गैस निकिल उत्प्रेरक की उपस्थिति में प्रवाहित की जाती है। तो तेलों को हाइड्रोजनीकरण होता है और वनस्पति घी बनता है। Ni उत्प्रेरक की क्रियाविधि को निम्न प्रकार समझाया जा सकता है –
- अभिकारक अणुओं (वनस्पति तेल, हाइड्रोजन) का सान्द्रण उत्प्रेरक की सतह पर बढ़ जाता है। जिसके कारण अभिक्रिया का वेग बढ़ता है।
- Ni उत्प्रेरक की सतह पर विद्यमान मुक्त संयोजकताएँ अभिकारक अणुओं (वनस्पति तेल, हाइड्रोजन) से अस्थायी संयोग कर संक्रियित संकर बना लेती हैं जिससे उनके आकार में तनाव आ जाता है।
- इस तनाव तथा संक्रियित संकर की अधिक ऊर्जा के कारण अभिकारक अणुओं (वनस्पति तेल, हाइड्रोजन) की क्रियाशीलता बढ़ जाती है और संक्रियित संकर शीघ्र ही अपघटित होकर उत्पाद देता
- इस प्रकार बने उत्पाद (वनस्पति घी) के अणु उत्प्रेरक की मुक्त संयोजकताओं को छोड़कर सतह से पृथक् हो जति हैं और अभिकारक के नये अणु फिर इसी क्रम को दोहराते हैं।
इसी सिद्धान्त के अन्तर्गत यह अनुभव किया गया है कि उत्प्रेरक (Ni) की सतह पर उत्प्रेरण क्षमता समान नहीं होती है। ठोस उत्प्रेरक के पृष्ठ पर कुछ बिन्दु ऐसे होते हैं, जहाँ अधिशोषित अभिकारी अणुओं का सान्द्रण अपेक्षाकृत अधिक होता है, क्योंकि इन बिन्दुओं पर मुक्त संयोजकताओं की संख्या अपेक्षाकृत अधिक होती है। इन बिन्दुओं को सक्रिय केन्द्र (active centres) कहते हैं। सक्रिय केन्द्र मुख्यत: दरारों (cracks), शिखरों (peaks), किनारों (edges) व कोनों (corners) पर होते हैं।
प्रश्न 3.
एन्जाइम उत्प्रेरण क्या है ? इनके सामान्य लक्षणों का उल्लेख कीजिए। (2009, 10, 11, 13, 16)
उत्तर
एन्जाइम (enzyme) जटिल, उच्च अणुभार वाले नाइट्रोजनयुक्त कार्बनिक पदार्थ हैं। ये पेड़-पौधों तथा जीव-जन्तुओं की जीवित कोशिका में उत्पन्न होते हैं। ये मुख्यत: प्रोटीनीय पदार्थ होते हैं और कोलॉइडी प्रकृति के होते हैं। ये बहुत-सी जीव रासायनिक अभिक्रियाओं में उत्प्रेरक का कार्य करते हैं; अतः इनको जीव रासायनिक (biochemical) उत्प्रेरक भी कहते हैं तथा इस घटना को एन्जाइम उत्प्रेरण कहते हैं। इनका नाम मुख्यत: ऐस पर समाप्त होता है; जैसे- जाइमेस, इन्वटेंस, माल्टेस, डायस्टेस, यूरिऐस आदि। इनकी क्रिया विषमांग उत्प्रेरणात्मक प्रकृति की होती है तथा क्रिया की गति अभिक्रिया में भाग लेने वाले पदार्थों की सान्द्रता के समानुपाती होती है। इन्वर्टेस एक प्रमुख एन्जाइम उत्प्रेरक है जो सुक्रोस का ग्लूकोस व फ्रक्टोस में परिवर्तन कर देता है।

एन्जाइमों के लक्षण
एन्जाइम उत्प्रेरण क्या है ? इनके सामान्य लक्षणों का उल्लेख कीजिए। (2009, 10, 11, 13, 16)
उत्तर
एन्जाइम (enzyme) जटिल, उच्च अणुभार वाले नाइट्रोजनयुक्त कार्बनिक पदार्थ हैं। ये पेड़-पौधों तथा जीव-जन्तुओं की जीवित कोशिका में उत्पन्न होते हैं। ये मुख्यत: प्रोटीनीय पदार्थ होते हैं और कोलॉइडी प्रकृति के होते हैं। ये बहुत-सी जीव रासायनिक अभिक्रियाओं में उत्प्रेरक का कार्य करते हैं; अतः इनको जीव रासायनिक (biochemical) उत्प्रेरक भी कहते हैं तथा इस घटना को एन्जाइम उत्प्रेरण कहते हैं। इनका नाम मुख्यत: ऐस पर समाप्त होता है; जैसे- जाइमेस, इन्वटेंस, माल्टेस, डायस्टेस, यूरिऐस आदि। इनकी क्रिया विषमांग उत्प्रेरणात्मक प्रकृति की होती है तथा क्रिया की गति अभिक्रिया में भाग लेने वाले पदार्थों की सान्द्रता के समानुपाती होती है। इन्वर्टेस एक प्रमुख एन्जाइम उत्प्रेरक है जो सुक्रोस का ग्लूकोस व फ्रक्टोस में परिवर्तन कर देता है।

एन्जाइमों के लक्षण
- ये उच्च अणुभार वाले जटिल नाइट्रोजन युक्त कार्बनिक पदार्थ हैं। ये उच्च कार्बनिक पदार्थों को सरलतम पदार्थों में बदलने की क्रियाओं को उत्प्रेरित करते हैं।
- एन्जाइम जल में कोलॉइडी विलयन बनाते हैं और इस अवस्था में बहुत प्रभावी उत्प्रेरक के रूप में कार्य करते हैं।
- एन्जाइम किसी उत्क्रमणीय अभिक्रिया की अन्तिम साम्य स्थिति को प्रभावित नहीं करते।
- एन्जाइम की उत्प्रेरक क्षमता अत्यन्त विशिष्ट होती है। एक विशेष एन्जाइम केवल एक ही अभिक्रिया को उत्प्रेरित कर सकता है। यदि कोई क्रिया कई पदों में होती है तो प्रत्येक पद के लिए भिन्न एन्जाइम उत्प्रेरक होता है। सुक्रोस से एथिल ऐल्कोहॉल बनने की क्रिया दो पदों में होती है जिनमें भिन्न-भिन्न एन्जाइम उत्प्रेरक उत्प्रेरण करते हैं।

- ये अधिक ताप (लगभग 70°C) और विषैले पदार्थों (वैद्युत-अपघट्य) से जल्दी प्रभावित हो जाते हैं। शरीर के ताप पर ये सबसे अच्छा कार्य करते हैं। इनकी क्रिया के लिए अनुकूलतम ताप 20°C – 30°C तक है।
- एन्जाइम की बहुत सूक्ष्म मात्रा ही पदार्थों की बहुत अधिक मात्रा को प्रभावित करती है।
- प्रक्रिया में बने पदार्थों के एकत्रित हो जाने से क्रिया धीमी हो जाती है।
- सह-एन्जाइम (co-enzyme) की उपस्थिति में इनकी क्रियाशीलता बढ़ जाती है।
- इनकी क्रियाशीलता पराबैंगनी किरणों द्वारा नष्ट हो जाती है।
- एन्जाइम उत्प्रेरक की क्रियाशीलता pH परिवर्तन से बहुत प्रभावित होती है। प्रत्येक एन्जाइम की उत्प्रेरक सक्रियता किसी pH पर अधिकतम होती है, जिसे अनुकूलन pH कहते हैं। एन्जाइमों की अनुकूलन pH साधारणतया 5 – 7 होती है।
इनका नाम उस अभिक्रिया की प्रकृति पर निर्भर होता है जिसमें ये भाग लेते हैं और ऑक्सीडेस, रिडक्ट्रेस, हाइड्रेलेस आदि कहलाते हैं।
प्रश्न 4.
कोलॉइडी विलयनों के सामान्य भौतिक गुणों का वर्णन कीजिए।
उत्तर
कोलॉइडी विलयनों के सामान्य भौतिक गुण निम्नवत् हैं –
कोलॉइडी विलयनों के सामान्य भौतिक गुणों का वर्णन कीजिए।
उत्तर
कोलॉइडी विलयनों के सामान्य भौतिक गुण निम्नवत् हैं –
- विषमांग प्रकृति – कोलॉइडी विलयन प्रकृति में विषमांग होते हैं तथा इनमें दो प्रावस्थाएँ-परिक्षिप्त । प्रावस्था और परिक्षेपण माध्यम होते हैं।
- स्थायित्व – सामान्यतः द्रवरागी सॉल तथा सूक्ष्म मात्रा में वैद्युत अपघट्य के उपस्थित होने पर द्रव-विरागी कोलॉइड स्थायी होते हैं तथा इनके परिक्षिप्त कण कुछ समय तक रखने पर नीचे नहीं बैठते हैं लेकिन लम्बे समय तक रखने पर बड़े आकार के कुछ कोलॉइडी कण बैठ जाते हैं।
- परिक्षिप्त कणों की दृश्यता – यद्यपि कोलॉइडी विलयन प्रकृति में विषमांग होते हैं लेकिन उनमें उपस्थित परिक्षिप्त कणों को नेत्रों द्वारा देखा जाना सम्भव नहीं है। नेत्रों द्वारा देखने पर ये समांग प्रतीत होते हैं। इसका कारण यह है कि नेत्र द्वारा देखे जाने वाले सबसे छोटे कणों की तुलना में भी कोलॉइडी कणों का आकार छोटा होता है। कोलॉइडी विलयनों के कणों को साधारण सूक्ष्मदर्शी द्वारा | भी नहीं देखा जा सकता है।
- छननता – अत्यन्त सूक्ष्म कणों की उपस्थिति के कारण कोलॉइडी विलयन सामान्य फिल्टर पेपर से पार हो जाते हैं, लेकिन जन्तु झिल्ली, सैलोफेन या अति सूक्ष्म फिल्टर से कोलॉइड़ी कण पार नहीं हो पाते हैं।
- रंग – कोलॉइडी विलयन का रंग परिक्षिप्त कणों के द्वारा प्रकीर्णित प्रकाश के तरंगदैर्ध्य पर निर्भर करता है। इसके अतिरिक्त, प्रकाश का तरंगदैर्ध्य कणों के आकार एवं प्रकृति पर निर्भर करता है। कोलॉइडी विलयनों का रंग प्रेक्षक द्वारा प्रकाश को ग्रहण करने के तरीके पर भी निर्भर करता है। उदाहरण के लिए दूध एवं पानी का मिश्रण परावर्तित प्रकाश में देखने पर नीला एवं संचरित प्रकाश में देखने पर लाल दिखाई देता है। सूक्ष्मतम कणों वाले गोल्ड सॉल का रंग लाल होता है, जैसे- जैसे कणों का आकार बढ़ता जाता है यह बैंगनी, फिर नीला और अन्त में स्वर्णिम हो जाता है।
प्रश्न 5.
समझाइए कि As2S3 के कोलॉइडी कण ऋणावेशित क्यों होते हैं? (2017)
उत्तर
आर्सेनियस ऑक्साइड और हाइड्रोजन सल्फाइड की अभिक्रिया से बने आर्सेनियस सल्फाइड के कण विलयन से सल्फाइड आयनों को पृष्ठ पर अधिशोषित करके ऋणावेशित हो जाते हैं। सल्फाइड आयन (S) प्राथमिक अधिशोषित स्तर और हाइड्रोजन आयन (H+) द्वितीयक विसरित स्तर बनाते हैं।
[As2S3]s2- : 2H+
इसलिए As2S3 के कोलॉइडी कण ऋणावेशित हो जाते हैं।
समझाइए कि As2S3 के कोलॉइडी कण ऋणावेशित क्यों होते हैं? (2017)
उत्तर
आर्सेनियस ऑक्साइड और हाइड्रोजन सल्फाइड की अभिक्रिया से बने आर्सेनियस सल्फाइड के कण विलयन से सल्फाइड आयनों को पृष्ठ पर अधिशोषित करके ऋणावेशित हो जाते हैं। सल्फाइड आयन (S) प्राथमिक अधिशोषित स्तर और हाइड्रोजन आयन (H+) द्वितीयक विसरित स्तर बनाते हैं।
[As2S3]s2- : 2H+
इसलिए As2S3 के कोलॉइडी कण ऋणावेशित हो जाते हैं।
प्रश्न 6.
ब्राउनियन गति पर एक संक्षिप्त टिप्पणी लिखिए। (2009, 16)
उत्तर
कोलॉइडी सॉल में कोलॉइडी कणों की लगातार टेढ़ी-मेढ़ी गति को ब्राउनियन गति कहा जाता है। ब्राउनियन गति कोलॉइडी कणों के आकार और सॉल की श्यानता पर निर्भर करती है। कोलॉइडी कणों का आकार जितना छोटा और श्यानता जितनी कम होगी, ब्राउनियन गति उतनी ही तीव्र होगी। यह कोलॉइड की प्रकृति पर निर्भर नहीं करती है। कोलॉइडी कणों पर गति करते हुये परिक्षेपण माध्यम के अणुओं के असमान प्रहारों के कारण ब्राउनियन गति उत्पन्न होती है।
ब्राउनियन गति पर एक संक्षिप्त टिप्पणी लिखिए। (2009, 16)
उत्तर
कोलॉइडी सॉल में कोलॉइडी कणों की लगातार टेढ़ी-मेढ़ी गति को ब्राउनियन गति कहा जाता है। ब्राउनियन गति कोलॉइडी कणों के आकार और सॉल की श्यानता पर निर्भर करती है। कोलॉइडी कणों का आकार जितना छोटा और श्यानता जितनी कम होगी, ब्राउनियन गति उतनी ही तीव्र होगी। यह कोलॉइड की प्रकृति पर निर्भर नहीं करती है। कोलॉइडी कणों पर गति करते हुये परिक्षेपण माध्यम के अणुओं के असमान प्रहारों के कारण ब्राउनियन गति उत्पन्न होती है।
परिक्षेपण माध्यम के अणु गति करते हुए सभी दिशाओं में कोलॉइडी कणों से लगातार टकराते हैं जिससे कोलॉइडी कणों में गृति आ जाती है। चूंकि कणों पर होने वाली टक्करों के बल असमान होते हैं इस कारण कोलॉइडी कण किसी विशेष दिशा में गति करते हैं। जैसे ही एक कण किसी निश्चित दिशा में गति करता है वैसे ही माध्यम के अन्य अणु इससे टकराते हैं जिससे कण अपने गति करने की दिशा में परिवर्तन कर लेता है। यह प्रक्रम लगातार चलने के कारण कण टेढ़े-मेढ़े पथ पर गति करता है। कोलॉइडी कणों के आकार बढ़ने पर ब्राउनियन गति का मान कम हो जाता है। यही कारण है कि निलम्बन (suspension) ब्राउनियन गति प्रदर्शित नहीं करते हैं।
प्रश्न 7.
हाड-शुल्जे नियम पर संक्षिप्त टिप्पणी लिखिए। (2010, 12, 15)
या
“आयनों का स्कन्दन प्रभाव आयनों की संयोजकता पर निर्भर करता है। इस कथन को उदाहरण देकर समझाइए। (2013)
उत्तर
अधिक मात्रा में वैद्युत-अपघट्य मिलाकर किसी कोलॉइडी विलयन की स्कन्दन (अवक्षेपण) क्रिया के लिए हार्डी-शुल्जे (Hardy – Schulze) ने निम्नलिखित दो नियम दिये, जिन्हें हार्डी-शुल्जे नियम कहते हैं –
हाड-शुल्जे नियम पर संक्षिप्त टिप्पणी लिखिए। (2010, 12, 15)
या
“आयनों का स्कन्दन प्रभाव आयनों की संयोजकता पर निर्भर करता है। इस कथन को उदाहरण देकर समझाइए। (2013)
उत्तर
अधिक मात्रा में वैद्युत-अपघट्य मिलाकर किसी कोलॉइडी विलयन की स्कन्दन (अवक्षेपण) क्रिया के लिए हार्डी-शुल्जे (Hardy – Schulze) ने निम्नलिखित दो नियम दिये, जिन्हें हार्डी-शुल्जे नियम कहते हैं –
- कोलॉइडी विलयन के स्कन्दन के लिए मिलाये गये वैद्युत-अपघट्य के वे आयन सक्रिय होते हैं, जिनका आवेश कोलॉइडी कणों के आवेश के विपरीत होता है।
- सॉल को स्कन्दित करने वाले आयन की शक्ति आयन की संयोजकता पर निर्भर होती है। समान संयोजकता वाले आयनों की स्कन्दित करने की शक्ति तथा मात्रा समान होती है। अधिक संयोजकता
वाले आयनों की स्कन्दन क्षमता अधिक होती है, अर्थात् हार्डी-शुल्जे नियम के अनुसार, ‘आयनों की स्कन्दन शक्ति आयन की संयोजकता बढ़ने के साथ बढ़ती है।’
यदि As2S3 सॉल में NaCl, BaCl2 तथा AlCl3 वैद्युत-अपघट्य अलग-अलग मिलाये जाएँ तो इनके Na+, Ba2+ तथा Al3+ आयन ऋण आवेशित As2S3 सॉल को अवक्षेपित कर देते हैं। हार्डी-शुल्जे के नियमानुसार, अधिक संयोजकता वाला आयन अधिक स्कन्दन करता है। अत: Al3+ , Ba2+ तथा Na+ आयनों की स्कन्दन क्षमता का क्रम निम्नलिखित होगा –
Al3+ > Ba2+ > Na+
अत: इन आयनों से Aspss के समान मात्रा में अवक्षेपण में NaCl, BaCl2 तथा AlCl3 की मात्रा का निम्नलिखित क्रम होगा –
NaCl > BaCl2 > AlCl3
इसी प्रकार, धनावेशित सॉल के प्रति ऋणायनों की स्कन्दन शक्ति निम्न प्रकार घटती है –
Fe(CN)4-6 > PO3-4 > SO2-4 > Cl–
Al3+ > Ba2+ > Na+
अत: इन आयनों से Aspss के समान मात्रा में अवक्षेपण में NaCl, BaCl2 तथा AlCl3 की मात्रा का निम्नलिखित क्रम होगा –
NaCl > BaCl2 > AlCl3
इसी प्रकार, धनावेशित सॉल के प्रति ऋणायनों की स्कन्दन शक्ति निम्न प्रकार घटती है –
Fe(CN)4-6 > PO3-4 > SO2-4 > Cl–
प्रश्न 8.
पायस, पायसीकरण तथा पायसीकारक को समझाइए। पायसों का निर्माण कैसे होता है? (2017)
उत्तर
पायस – द्रव के द्रव में परिक्षेपण को पायस कहते हैं। इसे निम्न प्रकार परिभाषित किया जा सकता है –
जब परिक्षेपण माध्यम एवं परिक्षिप्त प्रावस्था दोनों ही द्रव हों तो इन दोनों प्रावस्थाओं से बने कोलॉइडी विलयन को पायस कहा जाता है।
पायस, पायसीकरण तथा पायसीकारक को समझाइए। पायसों का निर्माण कैसे होता है? (2017)
उत्तर
पायस – द्रव के द्रव में परिक्षेपण को पायस कहते हैं। इसे निम्न प्रकार परिभाषित किया जा सकता है –
जब परिक्षेपण माध्यम एवं परिक्षिप्त प्रावस्था दोनों ही द्रव हों तो इन दोनों प्रावस्थाओं से बने कोलॉइडी विलयन को पायस कहा जाता है।
पायसों का निर्माण – दो द्रवों को प्रबल रूप से मिश्रित करके पायस बनाये जा सकते हैं। दो द्रवों को मिश्रित करने के लिये उच्च गति की मिश्रण मशीन (high speed mixing machine) या अल्ट्रासोनिक वाइब्रेटर (ultrasonic vibrator) का प्रयोग किया जाता है। इस प्रक्रम को पायसीकरण (emulsification) कहते हैं। चूंकि पायसों को बनाने में प्रयुक्त दोनों द्रव एक-दूसरे में अमिश्रणीय होते हैं अतः पायस को बनाने में एक स्थायीकारक की आवश्यकता होती है, जिसे पायसीकारक (emulsifier) कहा जाता है। पायसीकारक को घटक द्रवों के साथ मिलाया जाता है। o/w प्रकार के पायस के लिए प्रमुख पायसीकारक प्रोटीन, गोंद, प्राकृतिक एवं संश्लेषित साबुन आदि हैं जबकि w/o प्रकार के पायस के लिए वसीय अम्लों के भारी धातुओं के लवण, लंबी श्रृंखला वाले ऐल्कोहॉल, काजल (lamp black) आदि प्रमुख पायसीकारक हैं।
प्रश्न 9.
पायस कितने प्रकार के होते हैं? प्रत्येक का उल्लेख कीजिए। (2017)
उत्तर
परिक्षिप्त प्रावस्था की प्रकृति के आधार पर पायसों को निम्नलिखित दो श्रेणियों में वर्गीकृत किया जा सकता है –
पायस कितने प्रकार के होते हैं? प्रत्येक का उल्लेख कीजिए। (2017)
उत्तर
परिक्षिप्त प्रावस्था की प्रकृति के आधार पर पायसों को निम्नलिखित दो श्रेणियों में वर्गीकृत किया जा सकता है –
- जल में तेल (o/w) प्रकार के पायस – इस प्रकार के पायसों में तेल परिक्षिप्त प्रावस्था के रूप में कार्य करता है जबकि जल परिक्षेपण माध्यम की भाँति कार्य करता है। इस प्रकार के पायस के
उदाहरण दूध और वैनिशिंग क्रीम हैं। दूध में द्रव वसा जल में परिक्षिप्त रहती है। - तेल में जल (w/o) प्रकार के पायस – इस प्रकार के पायसों में जल परिक्षिप्त प्रावस्था की तरह कार्य करता है जबकि तेल परिक्षेपण माध्यम की भाँति कार्य करता है। इस प्रकार के पायस का मुख्य उदाहरण कॉड-लीवर तेल (cod liver oil) है। मक्खन (butter) और कोल्ड क्रीम (cold cream) भी इसी प्रकार के पायस हैं।
स्पष्ट है कि पायस का प्रकार दोनों द्रवों को सापेक्षिक मात्राओं पर निर्भर करता है। जल अधिक होने पर पायस जल में तेल प्रकार का पायस होता है जबकि तेल अधिक होने पर पायस तेल में जल प्रकार का पायस होता है। पायस का प्रकार पायसीकारक की प्रकृति पर भी निर्भर करता है। उदाहरणार्थ– पायसीकारक के रूप में विलेय साबुन की उपस्थिति से जल में तेल प्रकार के पायस का निर्माण होता है। जबकि अविलेय साबुन तेल में जल प्रकार के पायसों का निर्माण करते हैं।
दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
ठोसों पर गैसों के अधिशोषण को प्रभावित करने वाले कारकों का विस्तृत वर्णन कीजिए।
उत्तर
ठोस पदार्थों की सतहों पर गैसों का अधिशोषण अत्यन्त सामान्य है। एक ठोस की सतह पर असन्तुलित (unbalanced) आणविक बल उपस्थित रहते हैं। इन असन्तुलित बलों को सन्तुष्ट करने के लिए ही ठोस पदार्थ अन्य पदार्थों को अपनी सतह पर एकत्रित करते हैं।
ठोस पदार्थों की सतहों पर गैसों का अधिशोषण अग्रलिखित कारकों पर निर्भर करता है –
ठोसों पर गैसों के अधिशोषण को प्रभावित करने वाले कारकों का विस्तृत वर्णन कीजिए।
उत्तर
ठोस पदार्थों की सतहों पर गैसों का अधिशोषण अत्यन्त सामान्य है। एक ठोस की सतह पर असन्तुलित (unbalanced) आणविक बल उपस्थित रहते हैं। इन असन्तुलित बलों को सन्तुष्ट करने के लिए ही ठोस पदार्थ अन्य पदार्थों को अपनी सतह पर एकत्रित करते हैं।
ठोस पदार्थों की सतहों पर गैसों का अधिशोषण अग्रलिखित कारकों पर निर्भर करता है –
1. अधिशोषक की प्रकृति, पृष्ठ क्षेत्रफल तथा प्रविभाजित अवस्था – ठोस अधिशोषक की सतह पर एक अवशिष्ट बल क्षेत्र (residual force field) का होना आवश्यक है। यह क्षेत्र जितना अधिक होगा, उसमें अधिशोषण की प्रवृत्ति उतनी ही अधिक होगी। चूंकि अधिशोषण एक पृष्ठ घटना है, अत: इसके सम्पन्न होने की सीमा अधिशोषक के पृष्ठ क्षेत्रफल पर भी निर्भर करती है। अधिशोषक का पृष्ठ क्षेत्रफल जितना अधिक होगा, उसकी सतह पर उतना ही अधिक अधिशोषण होगा।
यही कारण है कि चारकोल और सिलिका जैल अच्छे अधिशोषक हैं क्योंकि वे सरंध्र (porous) होते हैं और इसलिए उनका पृष्ठीय क्षेत्रफल भी अत्यधिक होता है। एक अधिशोषक के पृष्ठ क्षेत्रफल में आश्चर्यजनक रूप से वृद्धि उसकी प्रविभाजित अवस्था (state of subdivision) में वृद्धि करके की जा सकती है। आकार में बड़े कणों की तुलना में उतने ही द्रव्यमान के सूक्ष्म वितरित (finely divided) कणों का पृष्ठ क्षेत्रफल बहुत अधिक होता है। यही कारण है कि कोलॉइडी अवस्था में स्थित एक पदार्थ निस्यन्द रूप में स्थित पदार्थ की तुलना में अधिक अच्छा अधिशोषक सिद्ध होता है। सूक्ष्म वितरित धातुएँ; जैसे- निकिल, प्लेटिनम आदि प्रभावशाली उत्प्रेरकों की भाँति कार्य करती हैं।
2. अधिशोषित पदार्थ की प्रकृति – किसी एक निश्चित ताप पर एक विशिष्ट अधिशोषक पर अधिशोषित होने वाली गैसों की मात्रा भी भिन्न-भिन्न होती है। नीचे सारणी में 288K पर 1 g चारकोल द्वारा अधिशोषित (NTP पर) विभिन्न गैसों के आयतन दिए गए हैं –

3. ताप – किसी अधिशोषक विशेष द्वारा किसी अधिशोषित गैस की मात्रा ताप में वृद्धि करने पर घटती है तथा ताप घटाने पर बढ़ती है। ताप में वृद्धि के साथ अधिशोषण में कमी को निम्न प्रकार समझा जा सकता है- अधिशोषण में दो प्रक्रम एक साथ होते हैं- ठोस के पृष्ठ पर गैस के अणुओं का संघनन अर्थात् अधिशोषण (adsorption) और ठोस के पृष्ठ से अणुओं का गैसीय प्रावस्था में वाष्पन अर्थात् विशोषण (desorption)। अधिशोषण एक ऊष्माक्षेपी प्रक्रम है तथा उपरोक्त दोनों प्रक्रमों में निम्न साम्य स्थापित हो जाता है –

ला- शातेलिए के नियमानुसार, ताप में वृद्धि करने पर अधिशोषण घटता है तथा ताप कम करने पर अधिशोषण में वृद्धि होती है।

ला- शातेलिए के नियमानुसार, ताप में वृद्धि करने पर अधिशोषण घटता है तथा ताप कम करने पर अधिशोषण में वृद्धि होती है।
4. दाब – स्थिर ताप पर, दाब में वृद्धि के साथ गैस के अधिशोषण में भी वृद्धि होती है। निम्न ताप पर जब दाब निम्न मानों से बढ़ाया जाता है तो गैसों के अधिशोषण में तीव्रता से वृद्धि होती है। विभिन्न स्थिर तापों पर 1 ग्राम चारकोल द्वारा N, गैस के अधिशोषण का दाब के साथ विचरण अग्र ग्राफ में दर्शाया गया है –

5. ठोस अधिशोषण का सक्रियण – अधिशोषक को सक्रियत करके अर्थात् उसके पृष्ठ क्षेत्रफल में वृद्धि करके भी उसकी अधिशोषण क्षमता में वृद्धि की जा सकती है। इसके लिए अधिशोषक को छोटे-छोटे टुकड़ों में तोड़ा जा सकता है। यहाँ यह विशेष रूप से ध्यान रखने योग्य है कि यदि तोड़ने पर अधिशोषक लगभग चूर्ण रूप में हो जाता है तो गैस उसमें प्रवेश नहीं कर पाती है और इस स्थिति में अधिशोषण घट जाता है।
अधिशोषक के पृष्ठ को खुरचकर अथवा रासायनिक विधि द्वारा खुरदरा बनाकर भी अधिशोषक की अधिशोषण क्षमता में वृद्धि की जा सकती है।
अधिशोषक के पृष्ठ को खुरचकर अथवा रासायनिक विधि द्वारा खुरदरा बनाकर भी अधिशोषक की अधिशोषण क्षमता में वृद्धि की जा सकती है।
अतिरिक्त अभ्यास
प्रश्न 1.
अधिशोषण एवं अवशोषण शब्दों (पदों) के तात्पर्य में विभेद कीजिए। प्रत्येक का एक उदाहरण दीजिए।
उत्तर
अधिशोषण तथा अवशोषण में अन्तर
(Difference between Adsorption and Absorption)
अधिशोषण एवं अवशोषण शब्दों (पदों) के तात्पर्य में विभेद कीजिए। प्रत्येक का एक उदाहरण दीजिए।
उत्तर
अधिशोषण तथा अवशोषण में अन्तर
(Difference between Adsorption and Absorption)

प्रश्न 2.
भौतिक अधिशोषण एवं रासायनिक अधिशोषण में क्या अन्तर है?
उत्तर
भौतिक अधिशोषण एवं रासायनिक अधिशोषण में अन्तर
(Difference between Physisorption and Chemisorption)
भौतिक अधिशोषण एवं रासायनिक अधिशोषण में क्या अन्तर है?
उत्तर
भौतिक अधिशोषण एवं रासायनिक अधिशोषण में अन्तर
(Difference between Physisorption and Chemisorption)

प्रश्न 3.
कारण बताइए कि सूक्ष्म-विभाजित पदार्थ अधिक प्रभावी अधिशोषक क्यों होता है?
उत्तर
सूक्ष्म विभाजित पदार्थ में सतही क्षेत्रफल (surface area) अधिक होने के कारण अधिशोषण के लिए अधिक सक्रिय केन्द्र उपस्थित होते हैं, इसलिए सूक्ष्म विभाजित पदार्थ अधिक प्रभावी अधिशोषक होते है।
कारण बताइए कि सूक्ष्म-विभाजित पदार्थ अधिक प्रभावी अधिशोषक क्यों होता है?
उत्तर
सूक्ष्म विभाजित पदार्थ में सतही क्षेत्रफल (surface area) अधिक होने के कारण अधिशोषण के लिए अधिक सक्रिय केन्द्र उपस्थित होते हैं, इसलिए सूक्ष्म विभाजित पदार्थ अधिक प्रभावी अधिशोषक होते है।
प्रश्न 4.
किसी ठोस पर गैस के अधिशोषण को प्रभावित करने वाले कारक कौन-से हैं?
उत्तर
किसी ठोस पर गैस के अधिशोषण को प्रभावित करने वाले कारक कौन-से हैं?
उत्तर
- अधिशोष्य तथा अधिशोषक की प्रकृति
- अधिशोषक का विशिष्ट सतही क्षेत्रफल तथा इसका सक्रियण
- गैस का दाब
- तापमान।
प्रश्न 5.
अधिशोषण समतापी वक्र क्या है? फ्रॉयडलिक अधिशोषण समतापी वक्र का वर्णन कीजिए।
उत्तर
अधिशोषण समतापी वक्र (Adsorption isotherm) – अधिशोषक के प्रति ग्राम में अधिशोषित गैस की मात्रा तथा स्थिर ताप पर अधिशोष्य (गैस) के दाब के बीच खींचा गया वक्र अधिशोषण समतापी वक्र कहलाता है।
फ्रॉयन्डलिक अधिशोषण समतापी वक्र (Freundlich adsorption isotherm) – फ्रॉयन्डलिक ने सन् 1909 में ठोस अधिशोषक के इकाई द्रव्यमान द्वारा एक निश्चित ताप पर अधिशोषित गैस की मात्रा एवं दाब के मध्य एक प्रयोग पर आधारित सम्बन्ध दिया। सम्बन्ध को निम्नलिखित समीकरण द्वारा व्यक्त किया जा सकता है –
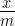 = kp1/n (n > 1)
= kp1/n (n > 1)
अधिशोषण समतापी वक्र क्या है? फ्रॉयडलिक अधिशोषण समतापी वक्र का वर्णन कीजिए।
उत्तर
अधिशोषण समतापी वक्र (Adsorption isotherm) – अधिशोषक के प्रति ग्राम में अधिशोषित गैस की मात्रा तथा स्थिर ताप पर अधिशोष्य (गैस) के दाब के बीच खींचा गया वक्र अधिशोषण समतापी वक्र कहलाता है।
फ्रॉयन्डलिक अधिशोषण समतापी वक्र (Freundlich adsorption isotherm) – फ्रॉयन्डलिक ने सन् 1909 में ठोस अधिशोषक के इकाई द्रव्यमान द्वारा एक निश्चित ताप पर अधिशोषित गैस की मात्रा एवं दाब के मध्य एक प्रयोग पर आधारित सम्बन्ध दिया। सम्बन्ध को निम्नलिखित समीकरण द्वारा व्यक्त किया जा सकता है –
जहाँ x, अधिशोषक के m द्रव्यमान द्वारा p दाब पर अधिशोषित गैस का द्रव्यमान है। k एवं n स्थिरांक हैं जो कि किसी निश्चित ताप पर अधिशोषक एवं गैस की प्रकृति पर निर्भर करते हैं। सम्बन्ध को सामान्यतया एक वक्र के रूप में निरूपित किया जाता है जिसमें अधिशोषक के प्रति ग्राम द्वारा अधिशोषित गैस का द्रव्यमान दाब के विपरीत आलेखित किया जाता है (चित्र-1)। ये वक्र व्यक्त करते हैं कि एक निश्चित दाब पर, ताप बढ़ाने से भौतिक अधिशोषण घटता है। ये वक्र उच्च दाब पर सदैव संतृप्तता की ओर बढ़ते प्रतीत होते हैं।

log
फ्रॉयन्डलिक समतापी वक्र की वैधता, आलेख में log
फ्रॉयन्डलिक समतापी अधिशोषण के व्यवहार की सन्निकट व्याख्या करता है। गुणक 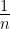 का मान 0 एवं 1 के मध्य हो सकता है (अनुमानित सीमा 0.1 से 0.5)। अत: समीकरण (ii) दाब के सीमित विस्तार तक ही लागू होती है।
का मान 0 एवं 1 के मध्य हो सकता है (अनुमानित सीमा 0.1 से 0.5)। अत: समीकरण (ii) दाब के सीमित विस्तार तक ही लागू होती है।
(i) जब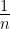 = 0,
= 0, 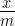 = स्थिरांक, अतः अधिशोषण दाब से स्वतन्त्र है।
= स्थिरांक, अतः अधिशोषण दाब से स्वतन्त्र है।
(i) जब
(ii) 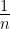 = 1,
= 1, 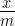 = kp अर्थात्
= kp अर्थात् 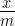 ∝ p, अत: अधिशोषण में परिवर्तन दाब के अनुक्रमानुपाती है।
∝ p, अत: अधिशोषण में परिवर्तन दाब के अनुक्रमानुपाती है।

प्रश्न 6.
अधिशोषक के सक्रियण से आप क्या समझते हैं? यह कैसे प्राप्त किया जाता है?
उत्तर
अधिशोषक के सक्रियण से तात्पर्य अधिशोषक की अधिशोषण क्षमता को बढ़ाना है। इसे अधिशोषक के पृष्ठीय क्षेत्रफल को बढ़ाकर किया जा सकता है। अधिशोषक के पृष्ठीय क्षेत्रफल को निम्नलिखित विधियों द्वारा बढ़ाया जा सकता है –
अधिशोषक के सक्रियण से आप क्या समझते हैं? यह कैसे प्राप्त किया जाता है?
उत्तर
अधिशोषक के सक्रियण से तात्पर्य अधिशोषक की अधिशोषण क्षमता को बढ़ाना है। इसे अधिशोषक के पृष्ठीय क्षेत्रफल को बढ़ाकर किया जा सकता है। अधिशोषक के पृष्ठीय क्षेत्रफल को निम्नलिखित विधियों द्वारा बढ़ाया जा सकता है –
- अधिशोषित गैसों को हटाकर अर्थात् चारकोल को 650 K से 1330 K के मध्य ताप पर निर्वात् अथवा अतितप्त भाप में गर्म करके सक्रिय किया जा सकता है।
- अधिशोषक को बारीक पीसकर अर्थात् सूक्ष्म विभाजित करके इसकी अधिशोषण क्षमता बढ़ाई जा सकती है।
- अधिशोषक की सतह को खुरदरा करके भी इसकी अधिशोषण क्षमता अर्थात् सक्रियता बढ़ाई जो सकती है।
प्रश्न 7.
विषमांगी उत्प्रेरण में अधिशोषण की क्या भूमिका है?
उत्तर
विषमांगी उत्प्रेरण में सामान्यत: ठोस अधिशोषक (उत्प्रेरक) तथा अभिकारक गैसें होती हैं। अभिक्रिया उत्प्रेरक की सतह पर होती है जहाँ अभिकारक अणु (अधिशोष्य) रासायनिक अधिशोषित होते हैं।
विषमांगी उत्प्रेरण में अधिशोषण की क्या भूमिका है?
उत्तर
विषमांगी उत्प्रेरण में सामान्यत: ठोस अधिशोषक (उत्प्रेरक) तथा अभिकारक गैसें होती हैं। अभिक्रिया उत्प्रेरक की सतह पर होती है जहाँ अभिकारक अणु (अधिशोष्य) रासायनिक अधिशोषित होते हैं।
प्रश्न 8.
अधिशोषण हमेशा ऊष्माक्षेपी क्यों होता है?
उत्तर
अधिशोषण होने पर पृष्ठ के अवशिष्ट बलों में सदैव कमी आती है अर्थात् पृष्ठ ऊर्जा में कमी आती है जो कि ऊष्मा के रूप में प्रकट होती है। अत: अधिशोषण सदैव एक ऊष्माक्षेपी प्रक्रम होता है। दूसरे शब्दों में, अधिशोषण का ΔH हमेशा ऋणात्मक होता है। जब एक गैस अधिशोषित होती है तो इसके अणुओं का संचलन सीमित हो जाता है। इससे अधिशोषण के पश्चात् गैस की एन्ट्रॉपी घट जाती है। किसी प्रक्रम के स्वत:प्रवर्तित होने के लिए ऊष्मागतिकीय आवश्यकता यह है कि स्थिर ताप एवं दाब पर ΔG ऋणात्मक होना चाहिए अर्थात् गिब्ज ऊर्जा में कमी होनी चाहिए।
अधिशोषण हमेशा ऊष्माक्षेपी क्यों होता है?
उत्तर
अधिशोषण होने पर पृष्ठ के अवशिष्ट बलों में सदैव कमी आती है अर्थात् पृष्ठ ऊर्जा में कमी आती है जो कि ऊष्मा के रूप में प्रकट होती है। अत: अधिशोषण सदैव एक ऊष्माक्षेपी प्रक्रम होता है। दूसरे शब्दों में, अधिशोषण का ΔH हमेशा ऋणात्मक होता है। जब एक गैस अधिशोषित होती है तो इसके अणुओं का संचलन सीमित हो जाता है। इससे अधिशोषण के पश्चात् गैस की एन्ट्रॉपी घट जाती है। किसी प्रक्रम के स्वत:प्रवर्तित होने के लिए ऊष्मागतिकीय आवश्यकता यह है कि स्थिर ताप एवं दाब पर ΔG ऋणात्मक होना चाहिए अर्थात् गिब्ज ऊर्जा में कमी होनी चाहिए।
समीकरण ΔG = ΔH – T ΔS के आधार पर ΔG तभी ऋणात्मक हो सकता है जब ΔH का मान पर्याप्त ऋणात्मक हो क्योकि – T ΔS का मान धनात्मक है। अत: अधिशोषण प्रक्रम में, जो कि स्वत:प्रवर्तित होती है, इन दोनों गुणकों का संयोजन ΔG को ऋणात्मक बनाता है। जैसे-जैसे अधिशोषण बढ़ता है ΔH कम ऋणात्मक होता जाता है एवं अन्त में ΔH, T ΔS के तुल्य हो जाता है एवं ΔG की मान शून्य हो जाता है। इसे अवस्था पर साम्य स्थापित हो जाता है।
प्रश्न 9.
कोलॉइडी विलयनों को परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम की भौतिक अवस्थाओं के आधार पर कैसे वर्गीकृत किया जाता है?
उत्तर
परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम की भौतिक अवस्थाओं के आधार पर वर्गीकरण (Classification based on the Physical state of Dispersed phase and Dispersion medium) – परिक्षिप्त प्रावस्था तथा परिक्षेपण माध्यम की भौतिक अवस्थाओं के आधार पर आठ प्रकार के कोलॉइडी तन्त्र सम्भव हैं। एक गैस का दूसरी गैस के साथ मिश्रण समांगी होता है, अत: यह कोलॉइडी तन्त्र नहीं होता। विभिन्न प्रकार के कोलॉइडों के उदाहरण उनके विशिष्ट नामों सहित निम्नांकित सारणी में दिए गए हैं –
सारणी – कोलॉइडी तन्त्रों के प्रकार (Types of Colloidal Systems)
कोलॉइडी विलयनों को परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम की भौतिक अवस्थाओं के आधार पर कैसे वर्गीकृत किया जाता है?
उत्तर
परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम की भौतिक अवस्थाओं के आधार पर वर्गीकरण (Classification based on the Physical state of Dispersed phase and Dispersion medium) – परिक्षिप्त प्रावस्था तथा परिक्षेपण माध्यम की भौतिक अवस्थाओं के आधार पर आठ प्रकार के कोलॉइडी तन्त्र सम्भव हैं। एक गैस का दूसरी गैस के साथ मिश्रण समांगी होता है, अत: यह कोलॉइडी तन्त्र नहीं होता। विभिन्न प्रकार के कोलॉइडों के उदाहरण उनके विशिष्ट नामों सहित निम्नांकित सारणी में दिए गए हैं –
सारणी – कोलॉइडी तन्त्रों के प्रकार (Types of Colloidal Systems)

प्रश्न 10.
ठोसों द्वारा गैसों के अधिशोषण पर दाब एवं ताप के प्रभाव की विवेचना कीजिए।
उत्तर
अधिशोषण पर दाब का प्रभाव (Effect of pressure on adsorption) – स्थिर ताप पर किसी ठोस में किसी गैस के अधिशोषण का अंश दाब के साथ बढ़ता है। स्थिर ताप पर ठोस में गैस के अधिशोषण के अंश (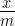 ) तथा गैस के दाब (p) के मध्य खींचा गया ग्राफ अधिशोषण समतापी वक्र कहलाता है।
) तथा गैस के दाब (p) के मध्य खींचा गया ग्राफ अधिशोषण समतापी वक्र कहलाता है।
फ्रॉयन्डलिक समतापी वक्र (Freundlich isotherm curve) – इस वक्र के अनुसार,
ठोसों द्वारा गैसों के अधिशोषण पर दाब एवं ताप के प्रभाव की विवेचना कीजिए।
उत्तर
अधिशोषण पर दाब का प्रभाव (Effect of pressure on adsorption) – स्थिर ताप पर किसी ठोस में किसी गैस के अधिशोषण का अंश दाब के साथ बढ़ता है। स्थिर ताप पर ठोस में गैस के अधिशोषण के अंश (
फ्रॉयन्डलिक समतापी वक्र (Freundlich isotherm curve) – इस वक्र के अनुसार,
- दाब की न्यूनतम परास में
आरोपित दाब के अनुक्रमानुपाती होता है।
∝ p1
- दाब के उच्च परास में
आरोपित दाब पर निर्भर नहीं करता है।
∝ p°
- दाबे के माध्यमिक परास में
का मान दाब की भिन्नात्मक घात के समानुपाती होता है।
∝ p1/n
जहाँएक भिन्न है। इसका मान 0 से 1 के बीच हो सकता है।
= kp1/n
log() = log k +
log p
अधिशोषण पर ताप का प्रभाव (Effect of temperature on adsorption) – अधिशोषण सामान्यतया ताप पर निर्भर होता है। अधिकांश अधिशोषण प्रक्रम ऊष्माक्षेपी होते हैं तथा इसलिए ताप बढ़ाने पर अधिशोषण घट जाता है। यद्यपि ऊष्माशोषी अधिशोषण प्रक्रमों में अधिशोषण ताप बढ़ने पर बढ़ जाता है।
प्रश्न 11.
द्रवरागी एवं द्रवविरागी सॉल क्या होते हैं? प्रत्येक का एक-एक उदाहरण दीजिए। द्रवविरोधी सॉल आसानी से स्कन्दित क्यों हो जाते हैं?
उत्तर
द्रवरागी सॉल (Lyophilic Sols) – द्रवरागी शब्द का अर्थ है- द्रव को स्नेह करने वाला। गोंद, रबड़ आदि पदार्थों को उचित द्रव (परिक्षेपण माध्यम) में मिलाने पर सीधे ही प्राप्त होने वाले कोलॉइडी सॉल द्रवरागी कोलॉइड कहलाते हैं। सॉल की एक महत्त्वपूर्ण विशेषता यह होती है कि यदि परिक्षेपण माध्यम को परिक्षिप्त प्रावस्था से अलग कर दिया जाए (माना वाष्पीकरण द्वारा) तो सॉल को केवल परिक्षेपण माध्यम के साथ मिश्रित करके पुन: प्राप्त किया जा सकता है। ऐसे सॉल उत्क्रमणीय सॉल (reversible sols) भी कहलाते हैं। इसके अतिरिक्त ये सॉल पर्याप्त स्थायी होते हैं एवं इन्हें आसानी से स्कन्दित नहीं किया जा सकता है। इस प्रकार के सॉल के उदाहरण गोंद, जिलेटिन, स्टार्च, रबड़ आदि हैं।
द्रवरागी एवं द्रवविरागी सॉल क्या होते हैं? प्रत्येक का एक-एक उदाहरण दीजिए। द्रवविरोधी सॉल आसानी से स्कन्दित क्यों हो जाते हैं?
उत्तर
द्रवरागी सॉल (Lyophilic Sols) – द्रवरागी शब्द का अर्थ है- द्रव को स्नेह करने वाला। गोंद, रबड़ आदि पदार्थों को उचित द्रव (परिक्षेपण माध्यम) में मिलाने पर सीधे ही प्राप्त होने वाले कोलॉइडी सॉल द्रवरागी कोलॉइड कहलाते हैं। सॉल की एक महत्त्वपूर्ण विशेषता यह होती है कि यदि परिक्षेपण माध्यम को परिक्षिप्त प्रावस्था से अलग कर दिया जाए (माना वाष्पीकरण द्वारा) तो सॉल को केवल परिक्षेपण माध्यम के साथ मिश्रित करके पुन: प्राप्त किया जा सकता है। ऐसे सॉल उत्क्रमणीय सॉल (reversible sols) भी कहलाते हैं। इसके अतिरिक्त ये सॉल पर्याप्त स्थायी होते हैं एवं इन्हें आसानी से स्कन्दित नहीं किया जा सकता है। इस प्रकार के सॉल के उदाहरण गोंद, जिलेटिन, स्टार्च, रबड़ आदि हैं।
द्रवविरागी या द्रवविरोधी सॉल (Lyophobic Sols) – द्रवविरागी शब्द का अर्थ है- द्रव से घृणा करने वाला। धातुएँ एवं उनके सल्फाइड आदि पदार्थ केवल परिक्षेपण माध्यम में मिश्रित करने से कोलॉइडी सॉल नहीं बनाते। इनके कोलॉइडी सॉल केवल विशेष विधियों द्वारा ही बनाए जा सकते हैं। ऐसे सॉल द्रवविरांगी सॉल कहलाते हैं। ऐसे सॉल को विद्युत अपघट्य की थोड़ी सी मात्रा मिलाकर, गर्म करके या हिलाकर आसानी से अवक्षेपित (या स्कन्दित) किया जा सकता है. इसलिए ये स्थायी नहीं होते। इसके अतिरिक्त एक बार अवक्षेपित होने के बाद ये केवल परिक्षेपण माध्यम के मिलाने मात्र से पुन: कोलॉइडी सॉल नहीं देते। अत: इनको अनुक्रमणीय सॉल (irreversible sols) भी कहते हैं। द्रवविरागी सॉल के स्थायित्व के लिए स्थायी कारकों की आवश्यकता होती है। इस प्रकार के सॉल के उदाहरण गोल्ड, सिल्वर, Fe(OH)3, As2O3 आदि हैं।
द्रवविरोधी सॉल का स्कन्दन (Coagulation of Lyophobic Sols) – द्रवविरोधी सॉल का स्थायित्व केवल कोलॉइडी कणों पर आवेश की उपस्थिति के कारण होता है। यदि आवेश हटा दिया जाए अर्थात् । उचित विद्युत-अपघट्य मिला दिया जाए तो कण एक-दूसरे के समीप आकर पुंजित हो जाएँगे अर्थात् ये स्कन्दित होकर नीचे बैठ जाएँगे। दूसरी ओर द्रवरागी सॉल का स्थायित्व कोलॉइड कणों के आवेश के साथ-साथ उनके विलायकयोजन (solvation) के कारण होता है। इन दोनों कारकों को हटाने के पश्चात् ही इन्हें स्कन्दित किया जा सकता है। अतः स्पष्ट है कि द्रवविरोधी सॉल आसानी से स्कन्दित हो जाते हैं।
प्रश्न 12.
बहुअणुक एवं वृहदाणुक कोलॉइड में क्या अन्तर है? प्रत्येक का एक-एक उदाहरण दीजिए। सहचारी कोलॉइड इन दोनों प्रकार के कोलॉइडों से कैसे भिन्न हैं?
उत्तर
बहुअणुक तथा वृहदाणुक कोलॉइड में अन्तर
(Difference between Multimolecular and Macromolecular Colloids)
बहुअणुक एवं वृहदाणुक कोलॉइड में क्या अन्तर है? प्रत्येक का एक-एक उदाहरण दीजिए। सहचारी कोलॉइड इन दोनों प्रकार के कोलॉइडों से कैसे भिन्न हैं?
उत्तर
बहुअणुक तथा वृहदाणुक कोलॉइड में अन्तर
(Difference between Multimolecular and Macromolecular Colloids)

प्रश्न 13.
एन्जाइम क्या होते हैं? एन्जाइम उत्प्रेरण की क्रिया-विधि को संक्षेप में लिखिए।
उत्तर
एन्जाइम (Enzyme) – एन्जाइम जटिल नाइट्रोजनयुक्त कार्बनिक यौगिक होते हैं जो जीवित पौधों एवं जन्तुओं द्वारा उत्पन्न किए जाते हैं। वास्तविक रूप से ये उच्च आण्विक द्रव्यमान वाले प्रोटीन अणु हैं जो जल में कोलॉइडी विलयन बनाते हैं। ये बहुत प्रभावी उत्प्रेरक होते हैं जो अनेक विशेष रूप से प्राकृतिक प्रक्रमों से सम्बद्ध अभिक्रियाओं को उत्प्रेरित करते हैं। इसी कारण इन्हें जैव उत्प्रेरक(biocatalyst) भी कहा जाता है। इन्वर्टेज, जाइमेज, डायस्टेज, माल्टेज एन्जाइम्स के कुछ विशिष्ट उदाहरण हैं।
एन्जाइम क्या होते हैं? एन्जाइम उत्प्रेरण की क्रिया-विधि को संक्षेप में लिखिए।
उत्तर
एन्जाइम (Enzyme) – एन्जाइम जटिल नाइट्रोजनयुक्त कार्बनिक यौगिक होते हैं जो जीवित पौधों एवं जन्तुओं द्वारा उत्पन्न किए जाते हैं। वास्तविक रूप से ये उच्च आण्विक द्रव्यमान वाले प्रोटीन अणु हैं जो जल में कोलॉइडी विलयन बनाते हैं। ये बहुत प्रभावी उत्प्रेरक होते हैं जो अनेक विशेष रूप से प्राकृतिक प्रक्रमों से सम्बद्ध अभिक्रियाओं को उत्प्रेरित करते हैं। इसी कारण इन्हें जैव उत्प्रेरक(biocatalyst) भी कहा जाता है। इन्वर्टेज, जाइमेज, डायस्टेज, माल्टेज एन्जाइम्स के कुछ विशिष्ट उदाहरण हैं।
एन्जाइम उत्प्रेरण की क्रियाविधि (Mechanism of Enzyme Catalysis) – एन्जाइम के कोलॉइडी कणों की सतहों पर बहुत सारे कोटर होते हैं। ये कोटर अभिलक्षणिक आकृति के होते हैं तथा इनमें सक्रिय समूह जैसे -NH2,- COOH, SH, –OH आदि होते हैं। वास्तव में ये सतह पर उपस्थित सक्रिय केन्द्र (active centres) होते हैं। अभिकारक के अणु जिनकी परिपूरक आकृति होती है, इन कोटरों में एक ताले में चाबी के समान फिट हो जाते हैं। सक्रिय समूहों की उपस्थिति के कारण एक सक्रियित संकुल बनता है जो विघटित होकर उत्पाद देता है।
इस प्रकार एन्जाइम उत्प्रेरित अभिक्रियाओं को दो पदों में सम्पन्न होना माना जा सकता है –
E + S [E – S] → E + P
[E – S] → E + P
इस प्रकार एन्जाइम उत्प्रेरित अभिक्रियाओं को दो पदों में सम्पन्न होना माना जा सकता है –
E + S

E + S → E – S
पद 2 : उत्पाद बनाने के लिए सक्रियित संकुल का विघटन ।
E – S → E + P
प्रश्न 14.
कोलॉइडों को निम्नलिखित आधार पर कैसे वर्गीकृत किया गया है?
कोलॉइडों को निम्नलिखित आधार पर कैसे वर्गीकृत किया गया है?
- घटकों की भौतिक अवस्था
- परिक्षेपण माध्यम की प्रकृति
- परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य अन्योन्यक्रिया।
उत्तर
- घटकों की भौतिक अवस्था (Physical states of constituents) – अभ्यास प्रश्न-संख्या 9 का अध्ययन कीजिए।
- परिक्षेपण माध्यम की प्रकृति (Nature of dispersion medium) – यदि परिक्षेपण माध्यम जल है तो ये एक्वासॉल या हाइड्रोसॉल कहलाते हैं। यदि परिक्षेपण माध्यम ऐल्कोहॉल है तो ये ऐल्कोसॉल कहलाते हैं। यदि परिक्षेपण माध्यम बेन्जीन है तो ये बेन्जोसॉल कहते हैं तथा परिक्षेपण माध्यम वायु होने पर ये ऐरोसॉल कहलाते हैं।
- परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य अन्योन्यक्रिया (Interaction between dispersed phase and dispersion medium) – परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य अन्योन्यक्रिया के आधार पर कोलॉइडी सॉल को दो वर्गों में विभाजित किया जा सकता है- द्रवरागी (विलायक को आकर्षित करने वाले) एवं द्रवविरागी (विलायक को प्रतिकर्षित करने वाले)। यदि परिक्षेपण माध्यम जल हो तो इन्हें क्रमश: जलरागी एवं जलविरागी कहा जाता है।
प्रश्न 15.
निम्नलिखित परिस्थितियों में क्या प्रेक्षण होंगे?
निम्नलिखित परिस्थितियों में क्या प्रेक्षण होंगे?
- जब प्रकाश किरण पुंज कोलॉइडी सॉल में से गमन करता है।
- जलयोजित फेरिक ऑक्साइड सॉल में NaCl विद्युत-अपघट्य मिलाया जाता है।
- कोलॉइडी सॉल में से विद्युत धारा प्रवाहित की जाती है।
उत्तर
- प्रकाश का प्रकीर्णन होता है (टिंडल प्रभाव)
- स्कन्दन
- कोलॉइडी कण गति करते हैं (वैद्युत-कण संचलन)।
प्रश्न 16.
इमल्शन क्या हैं? इनके विभिन्न प्रकार क्या हैं? प्रत्येक प्रकार का उदाहरण दीजिए।
उत्तर
दो अमिश्रणीय द्रवों का कोलॉइडी विलयन इमल्शन (पायस) कहलाता है।
इमल्शन क्या हैं? इनके विभिन्न प्रकार क्या हैं? प्रत्येक प्रकार का उदाहरण दीजिए।
उत्तर
दो अमिश्रणीय द्रवों का कोलॉइडी विलयन इमल्शन (पायस) कहलाता है।
- जल- में-तेल, उदाहरण, दूध;
- तेल-में-जल, उदाहरण, मक्खन।
प्रश्न 17.
विपायसन क्या है? दो विपायसकों के नाम लिखिए।
उत्तर
पायस को दो द्रवों में पृथक् करना विपायसन (demulsification) कहलाता है।
विपायसन क्या है? दो विपायसकों के नाम लिखिए।
उत्तर
पायस को दो द्रवों में पृथक् करना विपायसन (demulsification) कहलाता है।
- क्वथन
- अपकेंद्रण (centrifugation)।
प्रश्न 18.
“साबुन की क्रिया पायसीकरण एवं मिसेल बनने के कारण होती है, इस पर टिप्पणी लिखिए।
उत्तर
यह सत्य है कि साबुन की क्रिया पायसीकरण एवं मिसेल बनने के कारण होती है। इसे समझने के लिए हम साबुन के विलयन का उदाहरण लेते हैं। पानी में घुलनशील साबुन उच्च वसा अम्लों के सोडियम अथवा पोटैशियम लवण होते हैं जिन्हें RCOO– M+ द्वारा व्यक्त किया जा सकता है। उदाहरणार्थ– सोडियम स्टिएरेट, जो साबुन का एक प्रमुख घटक है, जल में विलीन करने पर C17H35COO– एवं Na+ आयनों में विघटित हो जाता है। किन्तु C17H35COO– आयन के दो भाग होते हैं–एक लम्बी हाइड्रोकार्बन श्रृंखला (जिसे ‘अध्रुवीय पुच्छ’ भी कहते हैं), जो जलविरागी (जल प्रतिकर्षी) होती है तथा ध्रुवीय समूह COO– (जिसे ‘ध्रुवीय आयनिक शीर्ष’ भी कहते हैं) जो जलरागी (जल को स्नेह करने वाला) होता है।
“साबुन की क्रिया पायसीकरण एवं मिसेल बनने के कारण होती है, इस पर टिप्पणी लिखिए।
उत्तर
यह सत्य है कि साबुन की क्रिया पायसीकरण एवं मिसेल बनने के कारण होती है। इसे समझने के लिए हम साबुन के विलयन का उदाहरण लेते हैं। पानी में घुलनशील साबुन उच्च वसा अम्लों के सोडियम अथवा पोटैशियम लवण होते हैं जिन्हें RCOO– M+ द्वारा व्यक्त किया जा सकता है। उदाहरणार्थ– सोडियम स्टिएरेट, जो साबुन का एक प्रमुख घटक है, जल में विलीन करने पर C17H35COO– एवं Na+ आयनों में विघटित हो जाता है। किन्तु C17H35COO– आयन के दो भाग होते हैं–एक लम्बी हाइड्रोकार्बन श्रृंखला (जिसे ‘अध्रुवीय पुच्छ’ भी कहते हैं), जो जलविरागी (जल प्रतिकर्षी) होती है तथा ध्रुवीय समूह COO– (जिसे ‘ध्रुवीय आयनिक शीर्ष’ भी कहते हैं) जो जलरागी (जल को स्नेह करने वाला) होता है।
C17H35COO– आयन पृष्ठ पर इस प्रकार उपस्थित रहते हैं कि उनका COO– समूह जल में तथा हाइड्रोकार्बन श्रृंखला C17H35 पृष्ठ से दूर रहती है। परन्तु क्रान्तिक मिसेल सान्द्रता पर ऋणायन विलयन के स्थूल में खिंच आते हैं एवं गोलीय आकार में इस प्रकार एकत्रित हो जाते हैं कि इनकी हाइड्रोकार्बन श्रृंखलाएँ गोले के केन्द्र की ओर इंगित होती हैं तथा COO– भाग गोले के पृष्ठ पर रहता है। इस प्रकार बना पुंज आयनिक मिसेल (ionic micelle) कहलाता है। इन मिसेलों में इस प्रकार के 100 तक आयन हो सकते हैं।



प्रश्न 19.
विषमांगी उत्प्रेरण के चार उदाहरण लिखिए।
उत्तर
विषमांगी उत्प्रेरण के चार उदाहरण लिखिए।
उत्तर
- अमोनिया निर्माण का हैबर प्रक्रम :
N2 + 3H22NH3
- सल्फ्यूरिक अम्ल निर्माण का सम्पर्क प्रक्रम :
2SO2 + O22SO3
- नाइट्रिक अम्ल निर्माण का ओस्टवाल्ड प्रक्रम :
4NH3 + 5O24NO + 6H2O
- वनस्पति तेल का हाइड्रोजनीकरण :
वनस्पति तेल (l) + H2 (g)वनस्पति घी (s)
प्रश्न 20.
उत्प्रेरक की सक्रियता एवं वरणक्षमता का क्या अर्थ है?
उत्तर
उत्प्रेरक की सक्रियता (Activity of catalyst) – उत्प्रेरक की किसी अभिक्रिया के वेग को बढ़ाने की क्षमता उत्प्रेरकीय सक्रियता कहलाती है।
उदाहरणार्थ– H2(g) + O2 (g) → कोई अभिक्रिया नहीं
O2 (g) → कोई अभिक्रिया नहीं
H2 (g) + O2 (g) + [Pt] → H2O (l) + [Pt] [विस्फोट के साथ तीव्र अभिक्रिया होती है।]
O2 (g) + [Pt] → H2O (l) + [Pt] [विस्फोट के साथ तीव्र अभिक्रिया होती है।]
उत्प्रेरक की सक्रियता एवं वरणक्षमता का क्या अर्थ है?
उत्तर
उत्प्रेरक की सक्रियता (Activity of catalyst) – उत्प्रेरक की किसी अभिक्रिया के वेग को बढ़ाने की क्षमता उत्प्रेरकीय सक्रियता कहलाती है।
उदाहरणार्थ– H2(g) +
H2 (g) +
बहुत सीमा तक एक उत्प्रेरक की सक्रियता रसोवशोषण की प्रबलता पर निर्भर करती है। सक्रिय होने के लिए अभिकारक, उत्प्रेरक पर पर्याप्त प्रबलता से अधिशोषित होने चाहिए। यद्यपि वे इतनी प्रबलता से अधिशोषित नहीं होने चाहिए कि वे गतिहीन हो जाएँ एवं अन्य अभिकारकों के लिए उत्प्रेरक की सतह पर कोई स्थान रिक्त न रहे।
उत्प्रेरक की वरणक्षमता (Selectivity of catalyst) – किसी उत्प्रेरक की वरणात्मकता उसकी किसी अभिक्रिया को दिशा देकर एक विशेष उत्पाद बनाने की क्षमता है। उदाहरणार्थ– H2 एवं CO से प्रारम्भ करके एवं भिन्न उत्प्रेरकों के प्रयोग से हम भिन्न- भिन्न उत्पाद प्राप्त कर सकते हैं।

इसी प्रकार एथेनॉल का विहाइड्रोजनीकरण तथा निर्जलीकरण दोनों सम्भव हैं, परन्तु उचित उत्प्रेरक की। उपस्थिति में केवल एक अभिक्रिया ही होती है।

इसी प्रकार एथेनॉल का विहाइड्रोजनीकरण तथा निर्जलीकरण दोनों सम्भव हैं, परन्तु उचित उत्प्रेरक की। उपस्थिति में केवल एक अभिक्रिया ही होती है।
- CH3CH2OH
CH3CHO + H2 (विहाइड्रोजनीकरण)
- CH3CH2OH
CH2= CH2 + H2O (निर्जलीकरण)
अतः यह निष्कर्ष निकाला जा सकता है कि उत्प्रेरक के कार्य की प्रकृति अत्यधिक विशिष्ट होती है अर्थात् कोई पदार्थ एक विशेष अभिक्रिया के लिए ही उत्प्रेरक हो सकता है, सभी अभिक्रियाओं के लिए नहीं। इसका अर्थ यह है कि एक पदार्थ जो एक अभिक्रिया में उत्प्रेरक का कार्य करता है, अन्य अभिक्रियाओं को उत्प्रेरित करने में असमर्थ हो सकता है।
प्रश्न 21.
जीओलाइटों द्वारा उत्प्रेरण के कुछ लक्षणों का वर्णन कीजिए।
उत्तर
जिओलाइटों द्वारा उत्प्रेरण के लक्षण (Features of Catalysis by Zeolites) –
जीओलाइटों द्वारा उत्प्रेरण के कुछ लक्षणों का वर्णन कीजिए।
उत्तर
जिओलाइटों द्वारा उत्प्रेरण के लक्षण (Features of Catalysis by Zeolites) –
- जिओलाइट जलयोजित ऐलुमिनो-सिलिकेट होते हैं जिनकी त्रिविमीय नेटवर्क संरचना होती है तथा इनके सरन्ध्रों में जल के अणु निहित होते हैं।
- जिओलाइटों को उत्प्रेरक के रूप में प्रयुक्त करने के लिए, इन्हें गर्म किया जाता है जिससे सरन्ध्रों में उपस्थित जलयोजन को जल निकल जाता है तथा सरन्ध्र रिक्त हो जाते हैं।
- सरन्ध्रों का आकार 260 से 740 pm के मध्य होता है, अतः केवल वे अणु ही इन सरन्ध्रों में अधिशोषित हो पाते हैं जिनका आकार सरन्ध्रों में प्रवेश करने हेतु पर्याप्त रूप से कम होता है। इसलिए ये आण्विक जाल (molecular sieves) या आकृति वरणात्मक उत्प्रेरक (shape selective catalyst) की भाँति कार्य करते हैं।
- जिओलाइट पेट्रोरसायन उद्योग में हाइड्रोकार्बनों के भंजन एवं समावयवन में उत्प्रेरक के रूप में व्यापक रूप से प्रयुक्त किए जा रहे हैं। ZSM- 5 पेट्रोलियम उद्योग में प्रयुक्त होने वाला एक महत्त्वपूर्ण जिओलाइट उत्प्रेरक है। यह ऐल्कोहॉल का निर्जलीकरण करके हाइड्रोकार्बनों का मिश्रण बनता है और उन्हें सीधे ही गैसोलीन (पेट्रोल) में परिवर्तित कर देता है।

जहाँ x, 5 से 10 के मध्य परिवर्तित होता है। ZSM- 5 का विस्तारित नाम Zeolite Sieve of Molecular Porosity-5′ है।
प्रश्न 22.
आकृति वरणात्मक उत्प्रेरण क्या है?
उत्तर
आकृति वरणात्मक उत्प्रेरण वह उत्प्रेरकीय क्रिया होती है जो उत्प्रेरक की छिद्र संरचना तथा अभिकारक/उत्पाद अणुओं के आकार पर निर्भर करती है। हाइड्रोकार्बनों के भंजन में जीओलाइट (ZSM- 5) का उपयोग आकृति वरणात्मक उत्प्रेरण का उदाहरण है।
आकृति वरणात्मक उत्प्रेरण क्या है?
उत्तर
आकृति वरणात्मक उत्प्रेरण वह उत्प्रेरकीय क्रिया होती है जो उत्प्रेरक की छिद्र संरचना तथा अभिकारक/उत्पाद अणुओं के आकार पर निर्भर करती है। हाइड्रोकार्बनों के भंजन में जीओलाइट (ZSM- 5) का उपयोग आकृति वरणात्मक उत्प्रेरण का उदाहरण है।
प्रश्न 23.
निम्नलिखित पदों (शब्दों) को समझाइए –
निम्नलिखित पदों (शब्दों) को समझाइए –
- विद्युत कण-संचलन
- स्कन्दन
- अपोहन
- टिण्डल प्रभाव। (2018)
उत्तर
1. विद्युत कण-संचलन (Electrophoresis) – कोलॉइडी कणों पर धनात्मक़ या ऋणात्मक विद्युत आवेश होता है। जिससे ये कण विद्युत क्षेत्र के प्रभाव में विपरीत आवेशित इलेक्ट्रोड की ओर अभिगमन करते हैं। विद्युत क्षेत्र में कोलॉइडी कणों के विपरीत आवेशित इलेक्ट्रोड की ओर अभिगमन (migration) की घटना को विद्युत कण-संचलन कहते हैं। कोलॉइडी कणों की कैथोड की ओर की गति को धन कण-संचलन (cataphoresis) तथा ऐनोड की ओर गति को ऋण कण-संचलन (anaphoresis) कहते हैं जैसे फेरिक हाइड्रॉक्साइड सॉल के कोलॉइडी कण धनावेशित होते हैं और ये कैथोड की ओर गति करते हैं। इसकी सहायता से कोलॉइडी विलयनों में कोलॉइडी कणों पर आवेश का अध्ययन किया जाता है।
1. विद्युत कण-संचलन (Electrophoresis) – कोलॉइडी कणों पर धनात्मक़ या ऋणात्मक विद्युत आवेश होता है। जिससे ये कण विद्युत क्षेत्र के प्रभाव में विपरीत आवेशित इलेक्ट्रोड की ओर अभिगमन करते हैं। विद्युत क्षेत्र में कोलॉइडी कणों के विपरीत आवेशित इलेक्ट्रोड की ओर अभिगमन (migration) की घटना को विद्युत कण-संचलन कहते हैं। कोलॉइडी कणों की कैथोड की ओर की गति को धन कण-संचलन (cataphoresis) तथा ऐनोड की ओर गति को ऋण कण-संचलन (anaphoresis) कहते हैं जैसे फेरिक हाइड्रॉक्साइड सॉल के कोलॉइडी कण धनावेशित होते हैं और ये कैथोड की ओर गति करते हैं। इसकी सहायता से कोलॉइडी विलयनों में कोलॉइडी कणों पर आवेश का अध्ययन किया जाता है।

3. अपोहन (Dialysis) – यह विधि इस तथ्य पर आधारित है कि घुलित पदार्थों के अणु व आयन चर्म-पत्र झिल्ली (parchment paper) में से सरलतापूर्वक विसरित हो जाते हैं, जबकि कोलॉइडी कण उसमें से विसरित नहीं हो पाते या कठिनाई से विसरित होते हैं।
चर्म- पत्र झिल्ली द्वारा कोलॉइडी विलयन में घुलित पदार्थों को पृथक् करने की विधि को अपोहन (dialysis) कहते हैं।
चर्म- पत्र झिल्ली द्वारा कोलॉइडी विलयन में घुलित पदार्थों को पृथक् करने की विधि को अपोहन (dialysis) कहते हैं।

4. टिण्डल प्रभाव (Tyndall effect) – जिस प्रकार अँधेरे कमरे में प्रकाश की किरण में धूल के कण चमकते हुए दिखाई पड़ते हैं, उसी प्रकार लेन्सों से केन्द्रित प्रकाश को कोलॉइडी विलयन पर डालकर समकोण दिशा में रखे एक सूक्ष्मदर्शी से देखने पर कोलॉइडी कण अँधेरे में घूमते हुए दिखाई देते हैं। इस घटना के आधार पर वैज्ञानिक टिण्डल ने कोलॉइडी विलयनों में एक प्रभाव का अध्ययन किया जिसे टिण्डल प्रभाव कहा गया, अतः कोलॉइडी कणों द्वारा प्रकाश के प्रकीर्णन (scattering of light) के कारण टिण्डल प्रभाव होता है।

प्रश्न 24.
इमल्शनों (पायस) के चार उपयोग लिखिए।
उत्तर
इमल्शनों (पायस) के चार उपयोग निम्नलिखित हैं –
इमल्शनों (पायस) के चार उपयोग लिखिए।
उत्तर
इमल्शनों (पायस) के चार उपयोग निम्नलिखित हैं –
- फेन प्लवन प्रक्रम द्वारा सल्फाइड अयस्क का सान्द्रण इमल्सीफिकेशन पर आधारित होता है।
- साबुन तथा डिटर्जेन्ट की शोधन क्रिया गन्दगी तथा साबुन के विलयन के मध्य इमल्शन बनने के कारण ही होती है।
- दूध जल में वसा का इमल्शन होता है।
- विभिन्न सौन्दर्य प्रसाधन; जैसे- क्रीम, हेयर डाई, शैम्पू आदि, अनेक औषधियाँ तथा लेप आदि इमल्शन होते हैं। इमल्शन के रूप में ये अधिक प्रभावी होते हैं।
प्रश्न 25.
मिसेल क्या हैं? मिसेल निकाय का एक उदाहरण दीजिए।
उत्तर
मिसेल (Micelles) – कुछ पदार्थ ऐसे होते हैं जो कम सान्द्रताओं पर सामान्य प्रबल विद्युत-अपघट्यों के समान व्यवहार करते हैं, परन्तु उच्च सान्द्रताओं पर कणों का पुंज बनने के कारण कोलॉइड के समान व्यवहार करते हैं। इस प्रकार के पुंजित कण मिसेलकहलाते हैं। उदाहरणार्थ– जल परिक्षेपण माध्यम में साबुन के अणुओं के स्टिएरेट की विभिन्न इकाइयाँ पुंजित कोलॉइडी आकार के कण बनाती हैं जो मिसेल कहलाते हैं। मिसेल को सहचारी कोलॉइड भी कहते हैं। जल में साबुन का सान्द्र विलयन एक मिसेल निकाय कहलाता है।
मिसेल क्या हैं? मिसेल निकाय का एक उदाहरण दीजिए।
उत्तर
मिसेल (Micelles) – कुछ पदार्थ ऐसे होते हैं जो कम सान्द्रताओं पर सामान्य प्रबल विद्युत-अपघट्यों के समान व्यवहार करते हैं, परन्तु उच्च सान्द्रताओं पर कणों का पुंज बनने के कारण कोलॉइड के समान व्यवहार करते हैं। इस प्रकार के पुंजित कण मिसेलकहलाते हैं। उदाहरणार्थ– जल परिक्षेपण माध्यम में साबुन के अणुओं के स्टिएरेट की विभिन्न इकाइयाँ पुंजित कोलॉइडी आकार के कण बनाती हैं जो मिसेल कहलाते हैं। मिसेल को सहचारी कोलॉइड भी कहते हैं। जल में साबुन का सान्द्र विलयन एक मिसेल निकाय कहलाता है।
प्रश्न 26.
निम्न पदों को उचित उदाहरण सहित समझाइए –
निम्न पदों को उचित उदाहरण सहित समझाइए –
- ऐल्कोसॉल
- ऐरोसॉल
- हाइड्रोसॉल।
उत्तर
- ऐल्कोसॉल (Alcosol) – वह कोलॉइड जिसमें परिक्षेपण माध्यम के रूप में ऐल्कोहॉल का प्रयोग किया जाता है, ऐल्कोसॉलकहलाता है। उदाहरणार्थ– एथिल ऐल्कोहॉल में सेलुलोस नाइट्रेट का कोलॉइडी सॉल (कोलोडियन)।
- ऐरोसॉल (Aerosol) – वह कोलॉइड जिसमें परिक्षेपण माध्यम वायु या गैस हो, ऐरोसॉल कहलाता है। उदाहरणार्थ– कोहरा।
- हाइड्रोसॉल (Hydrosol) – वह कोलॉइड जिसमें परिक्षेपण माध्यम जल हो, हाइड्रोसॉल कहलाता है। उदाहरणार्थ– स्टार्च सॉल।।
प्रश्न 27.
“कोलॉइड एक पदार्थ नहीं पदार्थ की एक अवस्था है।’ इस कथन पर टिप्पणी कीजिए।
उत्तर
कोई पदार्थ (ठोस, द्रव या गैस) विशेष विधियों के प्रयोग से कोलॉइडी अवस्था में परिवर्तित किया जा सकता है। उदाहरणार्थ– NaCl जल में वास्तविक विलयन (true solution) बनाता है लेकिन बेन्जीन में कोलॉइडी विलयन बनाता है। साबुन ऐल्कोहॉल में वास्तविक विलयन लेकिन जल में कोलॉइडी विलयन बनाता है।
“कोलॉइड एक पदार्थ नहीं पदार्थ की एक अवस्था है।’ इस कथन पर टिप्पणी कीजिए।
उत्तर
कोई पदार्थ (ठोस, द्रव या गैस) विशेष विधियों के प्रयोग से कोलॉइडी अवस्था में परिवर्तित किया जा सकता है। उदाहरणार्थ– NaCl जल में वास्तविक विलयन (true solution) बनाता है लेकिन बेन्जीन में कोलॉइडी विलयन बनाता है। साबुन ऐल्कोहॉल में वास्तविक विलयन लेकिन जल में कोलॉइडी विलयन बनाता है।
No comments:
Post a Comment